| Оксид марганца(VII) | |||
|---|---|---|---|
| |||
| Общие | |||
| Хим. формула | Mn2O7 | ||
| Физические свойства | |||
| Молярная масса | 220,8691 г/моль | ||
| Плотность | 2,397 (21°C) | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 5,9 °C | ||
| • разложения | 55 °C | ||
| Энтальпия | |||
| • образования | -726,3 (ж) кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | реагирует | ||
| • в ацетоне | воспламеняет | ||
| • в уксусном ангидриде | растворим | ||
| Классификация | |||
| Рег. номер CAS | 12057-92-0 | ||
| PubChem | 13879826 | ||
| Рег. номер EINECS | 235-025-8 | ||
| SMILES | |||
| InChI | |||
| Безопасность | |||
| Токсичность | токсичен | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||

Оксид марганца(VII) Mn2O7 — зеленовато-бурая или красная маслянистая жидкость с металлическим блеском (крёзовый цвет), неустойчив при комнатной температуре, при соприкосновении с горючими веществами воспламеняет их, возможно со взрывом. Высокотоксичен, сильнейший окислитель.

Физические свойства
Температура плавления — 5,9 °C. Разлагается со взрывом выше 55 °C или при контакте с органическими веществами.
В проходящем свете имеет красную окраску, в отражённом — зелёную. Образует кристаллы тёмно-зелёного цвета.
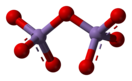
Молекулы состоят из пары тетраэдров с атомами кислорода в вершинах и атомами марганца в центрах. Сходная структура наблюдается у оксида хлора(VII), оксида технеция(VII) и оксида рения(VII).
Химические свойства
Оксид марганца(VII) — соединение кислорода и марганца, ангидрид марганцовой кислоты.
Получение
Получить оксид марганца(VII) Mn2O7 можно действием холодной концентрированной серной кислоты на перманганат калия:
Полученный оксид марганца(VII) неустойчив и разлагается на оксид марганца(IV) и кислород:

Одновременно выделяется озон:
Разложение оксида марганца(VII) может сопровождаться взрывом:

Взаимодействие с водой
Оксид марганца(VII) взаимодействует с водой, образуя марганцовую кислоту:
Взаимодействие с кислотами
Растворяется в серной кислоте, образуя гидросульфат триоксимарганца, более устойчивый при комнатной температуре:
Взаимодействие с органическими веществами
При контакте воспламеняет этиловый спирт, ацетон.
Обычно почти сразу, изредка в течении часа.









![{\displaystyle {\mathsf {Mn_{2}O_{7}+2H_{2}SO_{4}=2[MnO_{3}]^{+}[HSO_{4}]^{-}+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/515dacb7c0e12c3f9bb196455b390c0a2682a47b)