| Фторид иридия(VI) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Фторид иридия(VI) |
| Традиционные названия | Фтористый иридий |
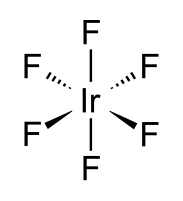
| Хим. формула | |
| Физические свойства | |
| Состояние | жёлтые кристаллы |
| Молярная масса | 306,2 г/моль |
| Плотность | 6,0 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 44,1; 44,4[1] |
| • кипения | 53; 54[1] °C |
| Энтальпия | |
| • образования | -580 кДж/моль |
| Классификация | |
| Рег. номер CAS | 7783-75-7 |
| PubChem | 3014587 |
| Рег. номер EINECS | 232-024-4 |
| SMILES | |
| InChI | |
| ChemSpider | 20082378 |
| Безопасность | |
| Токсичность | очень ядовит |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фтори́д ири́дия(VI) — неорганическое соединение, соль металла иридия и плавиковой кислоты с формулой жёлтые кристаллы, реагирует с водой.
Один из семнадцати известных бинарных гексафторидов. Это одно из немногих соединений, содержащих иридий в степени окисления +6.
Получение
Гексафторид иридия получают путем прямой реакции металлического иридия с избытком газообразного элементарного фтора при 300 °C. Однако он термически неустойчив и его необходимо вымораживать из газообразной реакционной смеси, чтобы избежать диссоциации:
- .
Физические свойства
Фторид иридия(VI) образует жёлтые кристаллы.
Химические свойства
Энергично реагирует с водой[2]:
- .
Реагирует с металлическим иридием:
- .
Примечания
- ↑ 1 2 CRC Handbook of Chemistry and Physics, 90th Edition, CRC Press, Boca Raton, Florida, 2009, ISBN 978-1-4200-9084-0, Section 4, Physical Constants of Inorganic Compounds, p. 4—85.
- ↑ Неорганическая химия / под ред. Ю. Д. Третьякова. М., Академия, 2007. С. 146.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
Обычно почти сразу, изредка в течении часа.



![{\displaystyle {\ce {Ir + 3 F2 ->[300\ ^{{\ce {o}}}{\ce {C}}] IrF6}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0a5099b9fe6539e1612954691d34a0643e118781)


![{\displaystyle {\ce {2 IrF6 + Ir ->[150\ ^{{\ce {o}}}{\ce {C}}] 3 IrF4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f75ba81768924bb825e1112456ada0c651a4546)