| Quinoleína | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Quinoleína | ||
| General | ||
| Fórmula estructural |
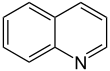 | |
| Fórmula molecular | C9H7N | |
| Identificadores | ||
| Número CAS | [91-22-5][1] | |
| Número RTECS | VA9275000 | |
| ChEBI | 17362 | |
| ChEMBL | CHEMBL14474 | |
| ChemSpider | 6780 | |
| PubChem | 7047 | |
| UNII | E66400VT9R | |
| KEGG | C06413 | |
| Propiedades físicas | ||
| Densidad | 1093 kg/m³; 1,093 g/cm³ | |
| Masa molar | 129,16 g/mol | |
| Punto de fusión | 258 K (−15 °C) | |
| Punto de ebullición | 510 K (237 °C) | |
| Propiedades químicas | ||
| Acidez | 4.85 pKa | |
| Solubilidad en agua | Ligeramente soluble en agua | |
| Termoquímica | ||
| ΔfH0líquido | 141.22 kJ/mol | |
| S0líquido, 1 bar | 219.72 J·mol–1·K–1 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
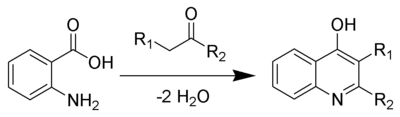
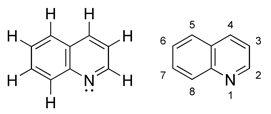
Las quinoleínas o quinolinas son compuestos orgánicos heterocíclicos formados por la unión de un núcleo derivado del benceno y otro piridínico; además estos compuestos poseen un isómero denominado isoquinoleína. Estos compuestos provienen de la naftalina y sólo habría que cambiar un átomo de nitrógeno por un grupo CH. Tiene fórmula química C9H7N.
La quinolina en sí misma tiene pocas aplicaciones, pero muchos de sus derivados son útiles en diversas aplicaciones. Un ejemplo prominente es la quinina, un alcaloide que se encuentra en las plantas. Las 4-Hidroxi2-alquilquinolinas (HAQs) están relacionadas con la resistencia a antibióticos.
YouTube Encyclopedic
-
1/3Views:1 536342701
-
Nomenclatura Heterocíclica 1: Furano, Tiofeno, Piridina, Diazinas, Indol, Quinolina, Isoquinolina
-
TEMA 40. QUINOLINA E ISOQUINOLINA | TEMARIO
-
Síntesis de Fármacos QIR. Síntesis de Indol, Quinolinas e Isoquinolinas.
Transcription
Historia
En 1834 el profesor de química alemán Friedrich Ferdinand Runge, de Breslau, destila Alquitrán de hulla y obtiene una sustancia incolora, fragante y soluble en 16 partes de agua fría; pero este químico -descubridor de la manera de extraer el azúcar de la remolacha- no analiza este líquido ni le da interés. Ni siquiera le da nombre.
En 1837 el francés Charles Frédéric Gerhardt, el gran organizador de la química orgánica, destilando quinina obtiene nuevamente la quinoleína, la cataloga y le da nombre. Descubre asimismo que esta sustancia era utilizada desde la antigüedad en el aceite de Dippel como remedio a las infecciones. De hecho este compuesto es denominado el antepasado de los antibióticos.
El descubrimiento de este compuesto supuso una auténtica revolución en el siglo XIX ya que con él podían tratarse numerosas infecciones dermatológicas, urinarias, ginecológicas e intestinales.
Presencia en la naturaleza
La quinolina se encuentra en la cocoa, el té negro, whisky y carbón de hulla. Es un constituyente importante del humo de cigarro. También se ha encontrado en varias plantas como Peganum harmala y Rubus laciniata, así como varias especies del género Mentha.[2]
Síntesis
- Síntesis de quinolinas de Skraup: Actualmente se obtiene por síntesis química, siguiendo los procedimientos descritos por Skraup que consisten básicamente en oxidar con nitrobenceno una mezcla de ácido sulfúrico, glicerina y anilina. Para los casos de quinolinas fusionadas con un segundo anillo de benceno, véase acridina y fenantridina.
- Síntesis de quinolina de Meth–Cohn
- Síntesis de quinolinas de Riehm
Aplicaciones
Puesto este compuesto en manos de la farmacología, se extrae primero un polvo cristalino y blanco denominado tartrato de quinoleína que combate la fiebre y las infecciones; después el salicilato de quinoleína y el sulfosalicilato de quinoleína todos con las mismas propiedades beneficiosas. Posteriormente se descubren las propiedades antisépticas y antibióticas de la oxiquinoleína y de la ortoxiquinoleína. Y más tarde se descubrió la potencia de la cloroquina y la amodiaquina para el tratamiento de la malaria.
La quinoleína encuentra muchos compuestos derivados de gran utilidad entre los que cabe mención el quiniofón y la yodoclorhidroxiquina como amebicidas.
Desde finales del siglo XIX se extraen numerosos colorantes de la quinoleína entre los que cabe destacar el amarillo de quinoleína (v. código alimentario E-104) y el rojo de quinoleína, este último utilizado para obtener placas fotográficas ortocromáticas; también se obtienen las llamadas cianinas que son unos colorantes verdes y azules ampliamente explotados en la fotografía, la imprenta y la industria textil, así es.
Datos técnicos
La fórmula básica de la quinoleína es C9H7N.

Véase también
Referencias
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Quinoleína.
Wikimedia Commons alberga una galería multimedia sobre Quinoleína.