La Síntesis de quinolinas de Knorr es un método de síntesis orgánica donde se convierte una β-cetoanilida en una 2-hidroxiquinoleína con ácido sulfúrico. Esta reacción fue descrita por primera vez por Ludwig Knorr (1859 - 1921) en 1886.[1]

La reacción es un tipo de sustitución electrófila aromática acompañada por una eliminación de agua. Un estudio de 1964 encontró que con ciertas condiciones de reacción se forma una 4-hidroxiquinoleína como reacción en competencia.[2] Por ejemplo, la benzoilacetanilida (1) forma la 2-hidroxiquinolina (2) con un gran exceso de ácido polifosfórico (PPA), pero se forma la 4-hidroxiquinoleína 3 cuando la concentración del PPA es baja. Un mecanismo de reacción identifica un intermediario N,O dicatiónico con exceso de ácido capaz de cerrar automáticamente el anillo y un intermediario monocatiónico B que se fragmenta en anilina y acetofenona (en última instancia). La anilina reacciona con otro equivalente de benzoilacetanilida antes de formar la 4-hidroxiquinoleína.

Un estudio en 2007[3] revisó el mecanismo de reacción, y basado en espectroscopia de RMN y cálculos teóricos se llegó a la conclusión de que se forma un intermediario O,O-dicatiónico (un superelectrófilo) sobre el intermediario N,O dicatiónico. Por cuestiones prácticas se recomienda´ácido tríflico:
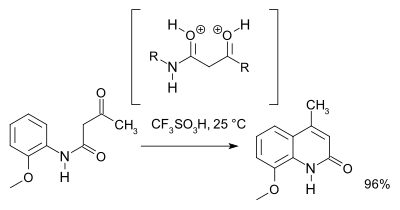
Referencias
- ↑ Synthetische Versuche mit dem Acetessigester Justus Liebig's Annalen der Chemie Volume 236, Issue 1-2, Date: 1886, Pages: 69-115 Ludwig Knorr doi 10.1002/jlac.18862360105
- ↑ The Conversion of Benzoylacetanilides into 2- and 4-Hydroxyquinolines B. Staskun J. Org. Chem. 1964; 29(5); 1153-1157. doi 10.1021/jo01028a038
- ↑ Knorr Cyclizations and Distonic Superelectrophiles Kiran Kumar Solingapuram Sai, Thomas M. Gilbert, and Douglas A. Klumpp J. Org. Chem. 2007, 72, 9761-9764 doi 10.1021/jo7013092
Véase también
- Síntesis de quinolinas de Combes
- Síntesis de quinolinas de Doebner
- Síntesis de quinolinas de Gould-Jacobs
- Síntesis de quinolinas de Riehm
- Síntesis de quinolinas de Skraup
- Síntesis de quinolinas de Pfitzinger
- Síntesis de quinolinas de Friedländer
- Síntesis de quinolinas de Conrad-Limpach
- Síntesis de quinolinas de Camps
- Síntesis de quinolinas de Doebner-Miller
- Síntesis de quinolinas de Niementowski
