| Окситетрахлорид вольфрама(VI) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Окситетрахлорид вольфрама(VI) |
| Традиционные названия | хлорокись вольфрама |
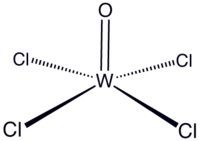
| Хим. формула | WOCl4 |
| Физические свойства | |
| Состояние | тёмно-красные кристаллы |
| Молярная масса | 341,66 г/моль |
| Плотность | 3,95; 11,92 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 204; 209 °C |
| • кипения | 224; 230; 232; 233 °C |
| Классификация | |
| Рег. номер CAS | 13520-78-0 |
| PubChem | 19596810 |
| Рег. номер EINECS | 236-863-7 |
| SMILES | |
| InChI | |
| ChemSpider | 21171360 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окситетрахлори́д вольфра́ма(VI) — неорганическое соединение, оксосоль металла вольфрама и соляной кислоты с формулой WOCl4, тёмно-красные кристаллы, реагирует с водой.
Получение
- Действие хлора на вольфрам при нагревании в присутствии воздуха:
- Действие хлора на вольфрам при нагревании в присутствии паров воды:
- Гидролиз хлорида вольфрама(VI) в тёплой воде:
- Окисление хлорида вольфрама(VI) кислородом воздуха:
- Реакция оксида вольфрама(VI) с тионилхлоридом при повышенной температуре:
Физические свойства
Окситетрахлорид вольфрама(VI) образует тёмно-красные кристаллы, легко очищаемые сублимацией.
Реагирует с водой. Растворяется в сероуглероде.
Химические свойства
- Реагирует с водой:
- Восстанавливается водородом при нагревании:
- Реагирует с углеродом при нагревании:
- При нагревании реагирует с оксидом кремния:
- Восстанавливается алюминием при повышенной температуре до окситрихлорида вольфрама:
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007. — Т. 3. — 352 с.
См. также
Обычно почти сразу, изредка в течении часа.






![{\displaystyle {\mathsf {WOCl_{4}+H_{2}O\ {\xrightarrow[{-HCl}]{}}\ WO_{2}Cl_{2}\ {\xrightarrow[{-HCl}]{}}\ WO_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7aac741b160753a34bd772fdf836edcbb8893acf)



