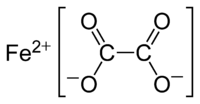
| Оксалат железа(II) | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Оксалат железа(II) |
| Традиционные названия | щавелевокислое железо |
| Хим. формула | FeC2O4 |
| Физические свойства | |
| Состояние | желтовато-белые кристаллы |
| Молярная масса | 143,86 г/моль |
| Плотность | гидрат 2,28 г/см³ |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,0725 г/100 мл |
| Классификация | |
| Рег. номер CAS | 516-03-0 |
| PubChem | 10589 |
| Рег. номер EINECS | 208-217-4 |
| SMILES | |
| InChI | |
| ChemSpider | 10144 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксалат железа(II) — неорганическое соединение, соль металла железа и щавелевой кислоты с формулой FeC2O4, желтовато-белые кристаллы, слабо растворяется в воде, образует кристаллогидрат.
Получение
- Действие оксалатами щелочных металлов на растворимые соли железа(II):
- Действие щавелевой кислоты на железо
- Fe + С2H2O4 = FeC2O4 + H2
Физические свойства
Оксалат железа(II) образует желтовато-белые кристаллы.
Образует кристаллогидрат состава FeC2O4•2H2O.
Слабо растворяется в воде.
Химические свойства
- Температурное разложение оксалата железа(II) известно получением при нем пирофорного железа, самовоспламеняющегося на воздухе. В среде углекислого газа пирофорное железо медленно восстанавливает CO2 до CO. Если перевернуть пробирку сразу после нагревания, то пирофорное железо будет сгорать, покинув среду CO2.
- Гидрат обезвоживается при 200°С.
- При смешении с раствором оксалата аммония или щелочного металла в подкисленной среде образует комплексную соль:
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
Обычно почти сразу, изредка в течении часа.



![{\displaystyle {\mathsf {FeC_{2}O_{4}+Na_{2}C_{2}O_{4}\xrightarrow {H^{+}} \ Na_{2}[Fe(C_{2}O_{4})_{2}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/29777912bb016e0cd41dcf89f2610fbccaa30937)