| Trietilaluminio | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Trietilaluminio | ||
| General | ||
| Fórmula semidesarrollada | (C2H5)3Al | |
| Fórmula molecular | C6H15Al | |
| Identificadores | ||
| Número CAS | 97-93-8[1] | |
| ChemSpider | 10179159 | |
| PubChem | 16682930 | |
| UNII | H426E9H3TT | |
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Densidad | 724 (a 1.013 bar) kg/m³; 0.724 a (1.013 bar) g/cm³ | |
| Masa molar | 114,17 g/mol | |
| Punto de fusión | 223 K (−50 °C) | |
| Punto de ebullición | 459,6 K (186 °C) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
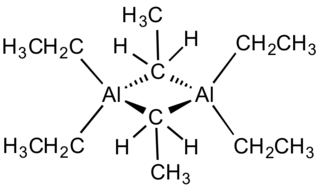
El trietilaluminio es un compuesto químico cuya fórmula es C6H15Al. Suele abreviarse escribiendo Et3Al. Es un líquido incoloro de olor característico. Es un compuesto volátil, reactivo frente a la hidrólisis y el aire, debido a la polaridad del enlace Al-C. Se trata de un compuesto pirofórico cuya estructura es dimérica, pero no es rígida, lo cual le permite establecer equilibrios con sus monómeros, pero éstos son muy reactivos y rápidamente evolucionan al dímero. En consecuencia, se puede afirmar que el trietialuminio es un dímero.
YouTube Encyclopedic
-
1/3Views:756 9543 4491 307
-
Aluminium (or Aluminum) - Periodic Table of Videos
-
Reacciones de alquinos, completar esquema
-
Tema 11 Elementos de Transición Compuestos de Coordinación Parte 2
Transcription
Síntesis industrial
La síntesis industrial del trietilaluminio es de gran importancia. Se denomina Proceso Ziegler y tiene la particularidad de usar el trietilaluminio como catalizador, siendo éste, a su vez, el producto de la reacción.
Al + 3/2H2 + 2Et3Al → 3Et2AlH (80-160 °C/100-200bar)
3Et2AlH + 3C2H4 → 3Et3Al (80-110 °C/1-10bar)
La suma de estas dos reacciones nos da la reacción global siguiente:
Al + 3/2H2 + 3C2H4 → Et3Al
Reactividad
A continuación citamos un conjunto de reacciones importantes en las que interviene el trietilaluminio:
Reacción con oxígeno
Et3Al + O2 → Al(OR)3
Reacción con hidrógeno
Et3Al + H2 → Et2AlH
Reacción con alcoholes
Et3Al + ROH → Et2Al(OR) + EtAl(OR)2 + Al(OR)3
Reacción con aminas
Et3Al + R2NH → Al(Et2(NR2))2
Reacción con olefinas: Ésta reacción es la inserción de un alqueno en el enlace Al-C. Esto es algo muy importante a nivel industrial ya que permite prolongar las cadenas unidas al Aluminio.
Et3Al + C2H3R → Et2AlCH2CHEtR
La polimerización de olefinas utiliza también el trietilaluminio, junto con tricloruro de titanio, como catalizadores. Ésta reacción es de gran relevancia a nivel industrial.
Aplicaciones
Además de ser importante, cómo hemos dicho, en la industria de los polímeros, otra de las aplicaciones que tiene el trietilaluminio es dentro del mundo de la electrónica. Se emplea como precursor para la deposición de óxido de aluminio.
Referencias
- Powell, P.; Chapman & Hall (1988). Principles of Organometallic Chemistry (2a edición).
- «Enciclopedia de los gases». Consultado el 31 de mayo de 2009.
