| Aldehído salicílico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 2-Hidroxibenzaldehido[1] | ||
| General | ||
| Otros nombres |
Salicilaldehido Aldehído salicílico O-Hidroxibenzaldehido | |
| Fórmula estructural |
 | |
| Fórmula molecular | C7H6O2 | |
| Identificadores | ||
| Número CAS | 90-02-8[2] | |
| Número RTECS | VN5250000 | |
| ChEBI | 16008 | |
| ChEMBL | 108925 | |
| ChemSpider | 13863618 | |
| PubChem | 6998 | |
| UNII | 17K64GZH20 | |
| KEGG | C06202 | |
|
O=Cc1ccccc1O
| ||
| Propiedades físicas | ||
| Masa molar | 122,037 g/mol | |
| Índice de refracción (nD) | 1,5740 | |
| Propiedades químicas | ||
| Acidez | 8,37 pKa | |
El aldehído salicílico (2-hidroxibenzaldehído), o salicilaldehído, es el compuesto orgánico con la fórmula C6H4CHO-2-OH.[3] Junto con el 3-
hidroxibenzaldehído y el 4-hidroxibenzaldehído, es uno de los tres isómeros del hidroxibenzaldehído. Es un líquido aceitoso incoloro que a una concentración más alta tiene olor a almendras amargas. El salicilaldehído es un precursor clave de una variedad de agentes quelantes, algunos de los cuales son comercialmente importantes.
Producción
El salicilaldehído se prepara a partir de fenol y cloroformo, calentándolos con hidróxido de sodio o con hidróxido de potasio en una reacción de Reimer–Tiemann:[4]

Alternativamente, se produce por condensación de fenol o sus derivados con formaldehído, lo cual genera alcohol hidroxibencílico, que se oxida al aldehído.
Los salicilaldehídos en general pueden prepararse a partir del fenol correspondiente mediante la reacción de Duff o mediante tratamiento con paraformaldehído en presencia de cloruro de magnesio y una base.[5]
Existencias naturales
El salicilaldehído se identificó como un componente aromático característico del trigo sarraceno.[6] También es uno de los componentes del castóreo, el exudado de las glándulas anales del castor norteamericano (Castor canadensis) maduro y del castor europeo (Castor fiber), utilizado en perfumería. Además, el salicilaldehído se produce en las secreciones defensivas de las larvas de varias especies de escarabajos foliares que pertenecen a la subtribu Chrysomelina. [7] Un ejemplo de una especie de escarabajo de las hojas que produce salicilaldehído es el escarabajo de la hoja de álamo rojo Chrysomela populi.
Reacciones y aplicaciones
El salicilaldehído se usa para obtener lo siguiente:
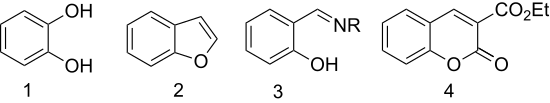
- La oxidación con peróxido de hidrógeno da catecol (1,2-dihidroxibenceno) (reacción de Dakin).[8].
- La eterificación con ácido cloroacético seguida de ciclación da el heterociclo benzofurano (cumarona).[9] El primer paso en esta reacción al benzofurano sustituido se denomina condensación Rap-Stoermer, por E. Rap (1895) y R. Stoermer (1900).[10][11]
- El salicilaldehído se convierte en ligandos quelantes por condensación con aminas. Con etilendiamina, se condensa para dar la salida del ligando. La hidroxilamina da salicilaldoxima.
- La condensación con malonato de dietilo da 3-carbetoxicumarina (un derivado de la cumarina), por una condensación aldólica.[12]
Referencias
- ↑ The Royal Society of Chemistry, ed. (2014). «Front Matter». Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge. p. 652. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
- ↑ Número CAS
- ↑ Merck Index, 11th Edition, 8295
- ↑ Brühne, F.; Wright, E. "Benzaldehyde". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.
- ↑ Trond Vidar Hansen; Lars Skattebøl (2005). "Ortho-Formylation of Phenols; Preparation of 3-Bromosalicylaldehyde". Organic Syntheses. 82: 64.
- ↑ Janeš, D.; Kreft, S. (2008). «Salicylaldehyde is a characteristic aroma component of buckwheat groats». Food Chemistry 109 (2): 293-298. PMID 26003350. doi:10.1016/j.foodchem.2007.12.032.
- ↑ Pauls, G., Becker, T., et al. (2016). [https://link.springer.com/article/10.1007/s10886-016-0684-0 Two Defensive Lines in Juvenile Leaf Beetles; Esters of 3-nitropropionic Acid in the Hemolymph and Aposematic Warning.] Journal of Chemical Ecology 42 (3) 240-248.
- ↑ Dakin, H. D. (1923). "Catechol". Org. Synth. 3: 28; Coll. Vol. 1: 149.
- ↑ Burgstahler, A. W.; Worden, L. R. (1966). "Coumarone". Org. Synth. 46: 28; Coll. Vol. 5: 251.
- ↑ Rap, E. (November 1895). «Sull' α-Benzoilcumarone» [On the α-Benzoylcoumaron]. Gazzetta Chimica Italiana 2 (4): 285-290.
- ↑ Stoermer, R. (1900). «Synthesen und Abbaureactionen in der Cumaronreihe». Liebig's Annalen der Chemie 312 (3): 237-336. doi:10.1002/jlac.19003120302.
- ↑ Horning, E. C.; Horning, M. G.; Dimmig, D. A. (1948). "3-Carbethoxycoumarin". Org. Synth. 28: 24; Coll. Vol. 3: 165.
Enlaces externos
- Esta obra contiene una traducción derivada de «Salicylaldehyde» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
