Una condensación aldólica es una reacción química orgánica donde un enol o enolato reacciona con un grupo carbonilo de aldehído o cetona para obtener un sistema conjugado de un carbonilo α,β-insaturado como producto final.

La condensación aldólica consta en realidad de dos reacciones que ocurren in situ: primero se forma un β-hidroxialdehído (aldol) o una β-hidroxicetona conforme a la reacción aldólica. Corrientemente, se obtiene un sistema conjugado de un carbonilo α,β-insaturado como producto final, a través de la deshidratación del intermedio, pero también es posible reiterar la condensación y dar lugar a polímeros.[1]

La reacción puede proceder en medio básico para formar un ion enolato como nucleófilo, o vía enol si el medio es ácido:

YouTube Encyclopedic
-
1/5Views:35 01558 9673 69316 0122 038
-
CONDENSACIÓN ALDÓLICA | Química Orgánica
-
Condensación aldólica
-
Condensación aldólica | | UPV
-
Condensación Aldólica y Reacción Aldólica | Reacción de Aldehídos y Cetonas con NaOH y Enolatos
-
TEMA 14. ENOLATOS | 14.8. CONDENSACIÓN ALDÓLICA
Transcription
Mecanismo
La condesación aldólica consta de dos etapas:
- La primera etapa es una adición tipo reacción aldólica
- La segunda etapa es una reacción de eliminación, que tiene lugar mediante un mecanismo del tipo E1cb en medio básico, donde se elimina el H α ácido produciendo el ion enolato que expulsa el grupo saliente -OH , o E1 o E2 en medio ácido, en donde se protona el -OH y se expulsa en agua. La deshidratación puede ir acompañada de descarboxilación cuando está presente un grupo carboxilo activado. El producto de adición de aldol se puede deshidratar mediante dos mecanismos; una base fuerte como t-butóxido de potasio, hidróxido de potasio o hidruro de sodio desprotona el producto a un enolato, que elimina a través del mecanismo E1cB,[2][3] mientras que la deshidratación en ácido procede a través de un mecanismo de reacción E1. Dependiendo de la naturaleza del producto deseado, la condensación aldólica se puede llevar a cabo bajo dos amplios tipos de condiciones: control cinético o control termodinámico.[4]

|

|
| animación, catálisis básica | animación, catálisis ácida |
Condensación aldólica cruzada
Una condensación aldólica cruzada es el resultado de dos compuestos de carbonilo diferentes que contienen α-hidrógeno(s) ácidos que experimentan condensación aldólica. Por lo general, esto conduce a cuatro productos posibles, ya que cualquiera de los compuestos carbonílicos puede actuar como nucleófilo y es posible la autocondensación (dimerización), lo que hace que la mezcla sea sintéticamente inútil. Sin embargo, este problema puede evitarse si uno de los compuestos no contiene un α-hidrógeno, haciéndolo no enolizable. En una condensación aldólica entre un aldehído y una cetona, la cetona actúa como nucleófilo, ya que su carbono carbonilo no posee un alto carácter electrofílico debido al efecto inductivo positivo (+I) y al impedimento estérico. Por lo general, el producto cruzado es el principal. Cualquier traza del producto de autoaldol del aldehído se puede rechazar preparando primero una mezcla de una base adecuada y la cetona y luego añadiendo el aldehído lentamente a dicha mezcla de reacción. El uso de una base demasiado concentrada podría llevar a una reacción de Cannizzaro competitiva.
En ciertos casos, se pueden utilizar carbonilos β,γ insaturados como nucleófilos para reaccionar con aldehídos α-carbonílicos, los cuales son altamente electrofílicos. Este es un caso distinto de condensación aldólica cruzada. Por ejemplo, el glutaconato de dietilo (carbonilo β,γ insaturado) 1 y el glioxilato de etilo 2 (aldehído α-carbonílico) se condensan con etóxido de sodio y forman el ácido 3-carboxi-cis,cis-mucónico . Este producto de reacción es muy inestable, el cual se descarboxila inicialmente y posteriormente proceden muchas reacciones secundarias. Se cree que esto se debe a la tensión estérica resultante del sustituyente metilo y el grupo carboxílico en la estructura cis-dienoide.[5]

Condensación de Claisen-Schmidt
Una aplicación notable de la condensación aldólica cruzada es la reacción entre un aldehído o una cetona que tiene un α-hidrógeno con un compuesto de carbonilo aromático que carece de un α-hidrógeno se llama condensación de Claisen-Schmidt. Esta reacción lleva el nombre de dos de sus investigadores pioneros Rainer Ludwig Claisen y JG Schmidt, quienes publicaron de forma independiente sobre este tema en 1880 y 1881.[6][7][8] Un ejemplo notable es la síntesis de chalconas por la reacción de un benzaldehído y una acetofenona en presencia de hidróxido de sodio como catalizador.[9][10]
Si la cetona presenta ambos carbonos α enolizables, entonces se puede formar la condensación aldólica cruzada con el benzaldehído en ambas posiciones. Por ejemplo, la acetona puede reaccionar con dos moléculas de benzaldehído para formar la dibenzilideneacetona ((1E, 4E) -1,5-difenilpenta-1,4-dien-3-ona).
Se han reportado rendimientos cuantitativos en las reacciones de Claisen-Schmidt en ausencia de solvente usando hidróxido de sodio como base y más benzaldehídos.[11]
En ocasiones, los factores estéricos, anquiméricos, inductivos o mesoméricos pueden afectar los rendimientos de la síntesis. Por ejemplo, La reacción entre la mentona ((2S, 5R) -2-isopropil-5-metilciclohexanona) y anisaldehído (4-metoxibenzaldehído) es complicada debido al impedimento estérico del grupo cetona. Este obstáculo se supera mediante el uso de una base fuerte como el hidróxido de potasio y un disolvente muy polar como el DMSO en la siguiente reacción:[12]

Condensación de Knoevenagel
En la condensación de Knoevenagel se lleva a cabo una condensación aldólica en la que el nucleófilo es un carbono activado (ácido) situado entre dos grupos electroatractores, los cuales forman un carbanión estabilizado por resonancia, por ejemplo un compuesto β-dicarbonílico. La adición se lleva a cabo sobre el carbonilo de un aldehído o cetona, seguida a continuación de la deshidratación.
En donde el electroatractor Z puede ser un carbonilo (cetona, éster o menos común, aldehído), nitro (-NO2) o nitrilo (-CN) Debido a que el carbono intermedio entre ambos carbonilos es más ácido, la condensación se lleva a cabo en condiciones básicas más suaves, por lo general en presencia de una amina no nucleofílica, en la forma de clorhidrato o acetato de la misma.[13]
Cuando el nucleófilo es un β-cetoéster, puede preceder una descarboxilación con pérdida del alcohol en lugar de una deshidratación, aplicando calor y un catalizador adecuado. Por ejemplo, en la condensación del 2-metilacetoacetato de etilo y el aldehído canfolénico en presencia de hidruro de sodio y dioxano procede con pérdida de un equivalente de etanol durante la descarboxilación:[14]

Variaciones
Proceso aldox
En la industria, el proceso Aldox desarrollado por Royal Dutch Shell y Exxon convierte el propeno, hidrógeno y monóxido de carbono directamente en 2-etilhexanol mediante hidroformilación, en donde se forma butiraldehído. este intermediario lleva a cabo la autocondensación aldólica para formar el 2-etilhexenal. Finalmente el producto de condensación se satura por hidrogenación.[15]
En un estudio, el crotonaldehído ((2E) -but-2-enal) se convierte directamente en 2-etilhexanal en un sistema de paladio / Amberlita / dióxido de carbono supercrítico:[16]
Reacción de Guerbet
En la reacción de Guerbet, un aldehído, formado in situ a partir de un alcohol, se autocondensa para formar el alcohol dimerizado:[17]
Condensación de Perkin
La reacción de Perkin es una reacción orgánica utilizada para sintetizar derivados del ácido cinámico (ácidos aromáticos α, β-insaturados) en la que se lleva una condensación aldólica entre un benzaldehído como aceptor y un anhídrido carboxílico en la presencia de una sal alcalina del ácido como nucleófilo. La variación consiste es que el aldol formado se esterifica con el grupo acilo del anhídrido y de alimina el carboxilato en lugar de agua:[18][19]

Condensación de Stobbe
La condensación de Stobbe[20] es una modificación específica para el éster dietílico del ácido succínico que requiere bases fuertes no nucleofílicas, como terbutóxido de potasio o hidruro de sodio. Un ejemplo es su reacción con benzofenona:[21]
Condensación de Baylis-Hillman
En la condensación de Baylis-Hillman se lleva a cabo de manera previa una adición de Michael de una base impedida estérica tal como el DABCO sobre un carbonilo α,β-insaturado. Al formar un enolato intermediario, éste se adiciona con un aldehído o cetona. La modificación con respecto a la condensación aldólica convencional es que la eliminación es preferente en el DABCO en lugar del hidroxilo:[22]
Aplicaciones biológicas
El nombre condensación aldólica también se usa comúnmente, especialmente en bioquímica, para referirse solo a la primera etapa (de adición) del proceso, la reacción aldólica en sí misma, catalizada por aldolasas. Sin embargo, la reacción aldólica no es formalmente una reacción de condensación porque no implica la pérdida de una molécula pequeña. Por lo tanto, en condiciones biológicas una condensación aldólica es reversible y controlada por dos enzimas termodinámica y cinéticamente independientes: las aldolasas (varias enzimas EC 4.1) que forman el aldol y las hidroliasas (EC 4.2.1) que catalizan la deshidratación.
Aplicaciones en métodos de síntesis
Síntesis de ciclopentadienonas
Se ha reportado la síntesis de ciclopentadienonas por dos condensaciones aldólicas cruzadas consecutivas, la primera intermolecular y la segunda intramolecular, a partir de una cetona con dos hidrógenos α y un sistema 1,2-dicarbonílico. Como ejemplo se ilustra la formación de tetrafenilciclopentadienona a partir de difenilacetona y difeniletanodiona:[23]
Síntesis de ciclohexenonas
La anelación de Robinson es un método de síntesis de carbociclos de seis miembros tipo ciclohexenona partiendo de una cetona y metil vinil cetona. La etapa de cierre de anillo se lleva a cabo por una condensación aldólica.

La cetona de Wieland-Miescher [24] es una dicetona bicíclica (enediona) que funge como un sintón versátil que hasta ahora se ha empleado en la síntesis total de más de 50 productos naturales, predominantemente sesquiterpenoides, diterpenos y esteroides que poseen diversas propiedades biológicas. Su preparación se realiza mediante la anelación de Robinson:
Síntesis de anillos heterocíclicos
La condensación aldólica es una reacción intermediaria muy recurrente en la síntesis de sistemas heterocíclicos. A continuación se mencionarán en ejemplos representativos:
- En la síntesis de tiofenos de Gewald,[25] la cual es una reacción multicomponente, tiene como primera etapa una condensación de Knoevenagel entre una cetona y un α-cianoéster (2):

- En la síntesis de 2H-cromanos que consisten en una ciclización catalizada por complejos de rutenio de alquinos terminales a cicloalquenos, un alquinol 1 se convierte en un cicloalqueno 7 con un catalizador de rutenio y los intermediarios de 3 a 5 corresponden a los una condensación aldólica. La justificación teórica para el mecanismo de reacción se basa en los resultados de marcaje isotópico.[26][27]

- En la síntesis de piridina de Chichibabin, la reacción multicomponente inicia con una condensación aldólica catalizada por bases:

En una síntesis similar, la síntesis de piridina de Hantzsch el mecanismo también se compone de una etapas inicial de una condensación de Knoevenagel de un compuesto β-dicarbonílico con un aldehído para formar una 1,4-dihidropiridina.[28]

En otro método de síntesis similar, la síntesis de piridonas de Guareschi Thorpe, el primer intermediario es una condensación de Knoevenagel de una β-cianoamida con un sistema β-dicarbonílico en presencia de amoniaco[29]
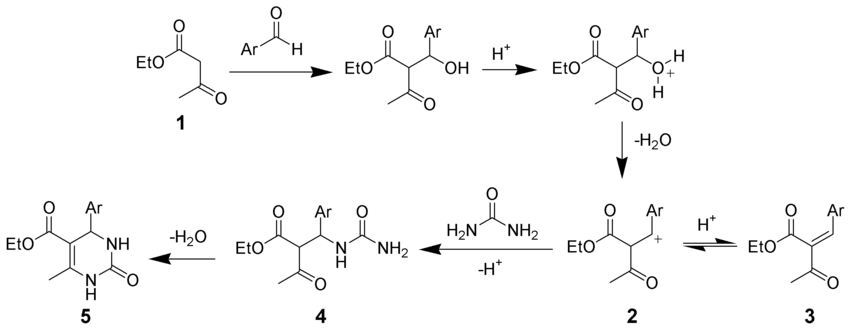
- En la síntesis de pirimidina de Biginelli, la primera etapa consiste en una condensación de Knoevenagel en medio ácido de un acetoacetato de etilo 1 y un benzaldehído[30]
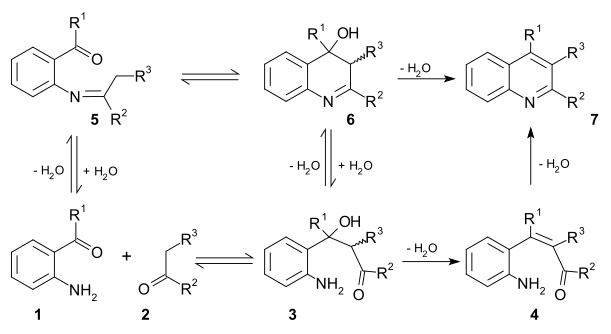
- En la Síntesis de quinolinas de Camps una o-acilaminoacetofenona reacciona intramolecularmente para cerrar el ciclo mediente una condensación aldólica:[31][32][33][34]

En un método similar, la Síntesis de quinolinas de Friedländer, hay dos propuestas de mecanismos, y en ambos participa una condensación aldólica intermedia:[35]
Referencias
- ↑ Morcillo, Jesús (1989). Temas básicos de química (2ª edición). Alhambra Universidad. p. 572. ISBN 9788420507828.
- ↑ Nielsen, A. T.; Houlihan., W. J. (1968). «The Aldol Condensation». Organic Reactions 16: 1-438. ISBN 0471264180. doi:10.1002/0471264180.or016.01.
- ↑ Perrin, C. L.; Chang, K. L. (2016). «The Complete Mechanism of an Aldol Condensation». J. Org. Chem. 81 (13): 5631-5. PMID 27281298. doi:10.1021/acs.joc.6b00959.
- ↑ Carey, Francis A.; Sundberg, Richard J. (1993). Advanced Organic Chemistry Part A: Structure and Mechanisms (3rd edición). New York, N.Y.: Plenum. pp. 458. ISBN 0-306-43440-7.
- ↑ Goren, M. B.; Sokoloski, E. A.; Fales, H. M. (2005). «2-Methyl-(1Z,3E)-butadiene-1,3,4-tricarboxylic Acid, "Isoprenetricarboxylic Acid"». Journal of Organic Chemistry 70 (18): 7429-7431. PMID 16122270. doi:10.1021/jo0507892.
- ↑ Claisen, L.; Claparède, A. (1881). «Condensationen von Ketonen mit Aldehyden» [Condensations of ketones with aldehydes]. Berichte der Deutschen Chemischen Gesellschaft 14 (1): 2460-2468. doi:10.1002/cber.188101402192.
- ↑ Schmidt, J. G. (1881). «Ueber die Einwirkung von Aceton auf Furfurol und auf Bittermandelöl in Gegenwart von Alkalilauge» [On the effect of acetone on furfural and on bitter almond oil (benzaldehyde) in the presence of alkali hydroxides]. Berichte der Deutschen Chemischen Gesellschaft 14 (1): 1459-1461. doi:10.1002/cber.188101401306.
- ↑ March, J. (1985). Advanced Organic Chemistry: Reactions, Mechanisms and Structure (3rd edición). Wiley Interscience. ISBN 0-471-85472-7.
- ↑ Dumitru, Sîrbu; Ion, Marin (2011). SYNTHESIS AND IR, NMR CARACTERISATION OF NEW P-(N,N-DIPHENYLAMINO) CHALCONES.
- ↑ Gómez-Rivera, Abraham; Aguilar-Mariscal, Hidemí; Romero-Ceronio, Nancy; Roa-de la Fuente, Luis F.; Lobato-García, Carlos E. (15 de octubre de 2013). «Synthesis and anti-inflammatory activity of three nitro chalcones». Bioorganic & Medicinal Chemistry Letters (en inglés) 23 (20): 5519-5522. ISSN 0960-894X. PMID 24012185. doi:10.1016/j.bmcl.2013.08.061. Parámetro desconocido
|doi-access=ignorado (ayuda) - ↑ Rahman A. F. M. Motiur, Ali Roushown, Jahng Yurngdong, Kadi Adnan A. (2012). «A Facile Solvent Free Claisen-Schmidt Reaction: Synthesis of α,α′-bis-(Substituted-benzylidene)cycloalkanones and α,α′-bis-(Substituted-alkylidene)cycloalkanones». Molecules 17: 571-583. doi:10.3390/molecules17010571. Parámetro desconocido
|doi-access=ignorado (ayuda) - ↑ Vashchenko, V.; Kutulya, L.; Krivoshey, A. (2007). «Simple and Effective Protocol for Claisen–Schmidt Condensation of Hindered Cyclic Ketones with Aromatic Aldehydes». Synthesis 2007 (14): 2125-2134. doi:10.1055/s-2007-983746.
- ↑ E. Knoevenagel, "Condensation von Malondiure mit Aromatiachen Aldehyden durch Ammoniak und Amine", Ber. Dtsch. Chem. Ges., 1898, 31(3), 2596-2619.
- ↑ Badía, C.; Castro, J. M.; Linares-Palomino, P. J.; Salido, S.; Altarejos, J.; Nogueras, M.; Sánchez, A. (2004). «(E)-6-(2,2,3-Trimethyl-cyclopent-3-enyl)-hex-4-en-3-one». Molbank 2004 (1): M388. doi:10.3390/M388. Parámetro desconocido
|doi-access=ignorado (ayuda) - ↑ Plantilla:Cite patent
- ↑ Seki, T.; Grunwaldt, J.-D.; Baiker, A. (2007). «Continuous catalytic "one-pot" multi-step synthesis of 2-ethylhexanal from crotonaldehyde». Chemical Communications 2007 (34): 3562-3564. doi:10.1039/b710129e.
- ↑ S. Veibel and J. I. Nielsen (1967). «On the mechanism of the Guerbet reaction». Tetrahedron 23 (4): 1723-1733. doi:10.1016/S0040-4020(01)82571-0.
- ↑ Perkin, W. H.; J. Chem. Soc. 1868, 21, 53, 181-186.
- ↑ Perkin, W. H.; J. Chem. Soc. 1877, 31, 660-674.
- ↑ Stobbe, H. (1899). «Condensation des Benzophenons mit Bernsteinsäureester». Justus Liebigs Annalen der Chemie 308 (1–2): 89-114. doi:10.1002/jlac.18993080106.
- ↑ Johnson, W. S. (1950). "β-CARBETHOXY-γ,γ-DIPHENYLVINYLACETIC ACID". Org. Synth. 30: 18; Coll. Vol. 4: 132.
- ↑ Baylis, A. B.; Hillman, M. E. D. German Patent 2155113, 1972.
- ↑ "Synthesis and assessment of new cyclopenta-2,4-dienone derivatives for energy storage applications". Zheng BangLim et al. Synthetic Metals. Volume 200, February 2015, Pages 85-90
- ↑ Wieland, P.; Miescher, K. Über die Herstellung mehrkerniger Ketone., Helv. Chim. Acta 1950, 33, 2215. doi 10.1002/hlca.19500330730
- ↑ Sabnis, R. W.; Rangnekar, D. W.; Sonawane, N. D. J. Heterocyclic Chem. 1999, 36, 333.
- ↑ Varela, J. A.; Gonzalez-Rodriguez, C.; Rubin, S. G.; Castedo, L.; Saa, C. (2006). «Ru-Catalyzed Cyclization of Terminal Alkynals to Cycloalkenes». Journal of the American Chemical Society 128 (30): 9576-9577. PMID 16866480. doi:10.1021/ja0610434.
- ↑ The ruthenium catalyst, [CpRu(CH3CN)3]PF6, has a cyclopentadienyl ligand, three acetonitrile ligands and a phosphorus hexafluoride counterion; the acidic proton in the solvent (acetic acid) is replaced by deuterium for isotopic labeling. Reaction conditions: 90°C, 24 hrs. 80% chemical yield. The first step is formation of the Transition metal carbene complex 2. Acetic acid adds to this intermediate in a nucleophilic addition to form enolate 3 followed by aldol condensation to 5 at which stage a molecule of carbon monoxide is lost to 6. The final step is reductive elimination to form the cycloalkene.
- ↑ Alan R. Katritzky, Daryl L. Ostercamp, and Taher I. Yousaf (1986). «The mechanism of the Hantzsch pyridine synthesis: a study by 15N and 13C NMR spectroscopy». Tetrahedron (42): 5729-5738.
- ↑ Guareschi, I. Mem. Reale Accad. Sci. Torino 1896, II, 7, 11, 25.
- ↑ Sweet, F.; Fissekis, J. D. (1973). «Synthesis of 3,4-dihydro-2(1H)-pyrimidinones and the mechanism of the Biginelli reaction». J. Am. Chem. Soc. 95 (26): 8741-8749. doi:10.1021/ja00807a040.
- ↑ Camps, R.; Ber. 1899, 22, 3228.
- ↑ Camps, R.; Arch. Pharm. 1899, 237, 659.
- ↑ Camps, R.; Arch. Pharm. 1901, 239, 591.
- ↑ Manske, R. H. F.; Chem. Rev. 1942, 30, 127. (Review)
- ↑ Jose Marco-Contelles; Elena Perez-Mayoral; Abdelouahid Samadi; Marıa do Carmo Carreiras; Elena Soriano (2009). «Recent Advances in the Friedlander Reaction». Chemical Reviews 109 (6): 2652-71. PMID 19361199. doi:10.1021/cr800482c.
 Wikimedia Commons alberga una categoría multimedia sobre Condensación aldólica.
Wikimedia Commons alberga una categoría multimedia sobre Condensación aldólica.