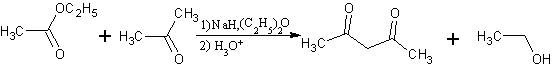La condensación de Claisen es una reacción de la química orgánica que tiene lugar entre dos ésteres o un éster y una cetona en presencia de una base fuerte, dando lugar a un β-cetoéster o a una β-dicetona. Es una reacción donde se forma un enlace sencillo carbono-carbono (C-C). Su nombre es en honor del químico alemán Rainer Ludwig Claisen, que publicó su trabajo sobre la reacción en 1887.[1][2][3]

YouTube Encyclopedic
-
1/3Views:2 75619 6107 524
-
CONDENSACIÓN DE CLAISSEN
-
Condensación aldólica
-
Completar secuencia de reacciones (aldólica, Michael, malónica, Claisen mixta)
Transcription
Requisitos
Al menos uno de los reactivos ha de ser enolizable. Esto significa tener un hidrógeno en la posición α respecto al carbonilo para poder formar el enolato. Hay diferentes combinaciones de compuestos carbonílicos no enolizables o enolizables que constituyen diferentes tipos de condensaciones de Claisen.
La base usada no debe interferir con la reacción. Así pues tanto el alcóxido como el éster deben derivar del mismo alcohol para evitar problemas de transesterificación.
Tipos
- La condensación de Claisen clásica:

1: acetato de etilo; 2: acetoacetato de etilo; 3: etanol
- La condensación de Claisen mixta (o cruzada), donde un éster o una cetona enolizables y un éster no enolizable son empleados.

1: benzoato de etilo; 2: acetofenona; 3: 1,3-difenilpropano-1,3-diona; 4: etanol
- La condensación de Dieckmann, donde una molécula con dos grupos éster reacciona de manera intramolecular, formando un β-cetoéster cíclico. Los anillos de 5 o 6 miembros están favorecidos.
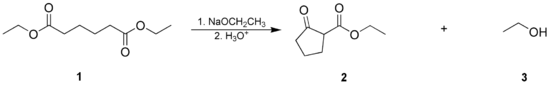
1: adipato de dietilo; 2: 2-oxociclopentanocarboxilato de etilo; 3: etanol
- La Transposición de Baker-Venkataraman es una reacción orgánica en donde se hacen reaccionar 2-acetoxiacetofenonas con una base para formar 1,3-dicetonas por condensación de Claisen.
Subtipo
Aprovechando la mayor acidez de las cetonas respecto a los éster, aquellas también dan condensaciones de Claisen mixtas con ésteres enolizables:
En este caso la cetona se desprotona antes que el éster. La utilización de una base más fuerte que el alcóxido suele dar mejores rendimientos.
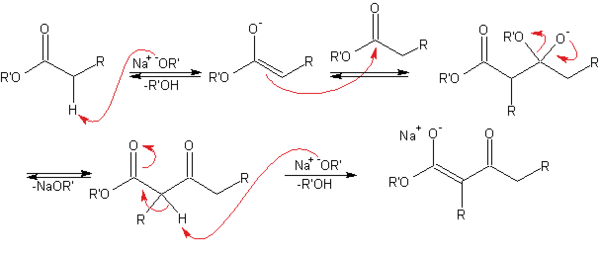
Mecanismo
En el primer paso, el éster es desprotonado por la base, dando lugar al anión enolato, relativamente estable debido a la deslocalización electrónica. A continuación, el carbonilo de otra molécula del éster sufre el ataque nucleófilo del carbono en α del enolato. El grupo alcoxi se elimina, regenerándose el alcóxido. La reacción se desplaza hacia el producto final debido a la conversión del β-cetoéster, relativamente ácido (pKa~11) en la posición contigua a los dos carbonilos, en su enolato, que está estabilizado por resonancia.
El paso final de la síntesis, que no aparece en el mecanismo, es el tratamiento con solución acuosa ácida para neutralizar el enolato y obtener el β-cetoéster (o 3-cetoéster).
|
| Mecanismo animado que sí incluye el paso final. |
Véase también
Referencias
- Carey, Francis A. (2006). Organic Chemistry (Sixth Edition edición). New York, NY: McGraw-Hill. ISBN 0-07-111562-5.
- Claisen, L., and A. Claparede. Ber. Deut. Chem. Ges., 1887, 14, 2460.
- Claisen, L. Ber. Deut. Chem. Ges., 1887, 20, 655.
- ↑ Claisen, L.; Claparede, A. (1881). «Condensationen von Ketonen mit Aldehyden». Berichte der Deutschen Chemischen Gesellschaft 14 (2): 2460-2468. doi:10.1002/cber.188101402192.
- ↑ Claisen, L. (1887). «Ueber die Einführung von Säureradicalen in Ketone». Berichte der Deutschen Chemischen Gesellschaft 20 (1): 655-657. doi:10.1002/cber.188702001150.
- ↑ Hauser, C. R.; Hudson, B. E. Jr. (1942). «The Acetoacetic Ester Condensation and Certain Related Reactions». Organic Reactions 1. doi:10.1002/0471264180.or001.09.
Bibliografía
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.