| Carbazol | ||
|---|---|---|
 | ||
| <span class="mw-file-element mw-broken-media" data-width="320">Archivo:Carbazole-3D-vdW.png y Carbazole-3D-balls.png</span> | ||
| Nombre IUPAC | ||
| 9H-carbazol, 9-azafluoreno, dibenzopirrol, difenilenimina, difenilenimida | ||
| General | ||
| Fórmula estructural |
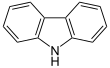 | |
| Fórmula molecular | C12H9N | |
| Identificadores | ||
| Número CAS | 86-74-8[1] | |
| ChEBI | 27543 | |
| ChEMBL | CHEMBL243580 | |
| ChemSpider | 6593 | |
| DrugBank | 07301 | |
| PubChem | 6854 | |
| UNII | 0P2197HHHN | |
| KEGG | C08060 | |
| Propiedades físicas | ||
| Apariencia | Escamas monoclínicas | |
| Densidad | 1,301 kg/m³; 0,001301 g/cm³ | |
| Masa molar | 167,206 g/mol | |
| Punto de fusión | 246,3 °C (519 K) | |
| Punto de ebullición | 354,69 °C (628 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El carbazol es un compuesto aromático heterocíclico. Es un triciclo que consiste en un anillo de pirrol con dos anillos de benceno fusionados en los enlaces b y d. Se puede considerar también como un anillo de indol con un átomo de benceno fusionado en el enlace b. Otra descripción establece que el carbazol es un 9-azafluoreno.
YouTube Encyclopedic
-
1/2Views:1 784367
-
SFCM 13/14 20: DISEÑO DE POLÍMEROS CONJUGADOS PARA APLICACIONES FOTOVOLTAICAS
-
Beneficios Medicinales Probados de las Hojas de Curry
Transcription
Propiedades
Cristaliza con etanol, benceno, tolueno y ácido acético glacial. Exhibe una fuerte fluorescencia y larga fosforescencia por exposición con luz ultravioleta. Es una base muy débil. Insoluble en agua. Un gramo se disuelve en 3 mL de quinolina, 6 mL de piridina, 9 mL de acetona a 50°, 35 mL de éter, 120 mL de benceno y 135 mL de etanol absoluto. Se disuelve ligeramente en éter de petróleo, disolventes organoclorados y ácido acético. Se disuelve en ácido sulfúrico sin descomposición. La dosis letal oral en ratas es LD50>5g/kg.[2]
Síntesis
Reacción de Pschorr
La reacción de Pschorr es una variante intramolecular de la Reacción de Gomberg-Bachmann, en donde ambos anillos se encuentran vinculados por un grupo bivalente. Para carbazoles, Z = NH (Puente imino):[3][4][5][6]
La Ciclización de Borsche-Drechsel es un método clásico de síntesis de 1,2,3,4 tetrahidrocarbazoles.[7][8]
Otro método para la síntesis de carbazoles es la Reacción de Graebe–Ullmann.[9][10]

Un tercer método para obtener carbazoles es la síntesis de Cadogan.[11]

También se puede utilizar el método de Bucherer:[12]

Iwaki y colaboradores reportaron un método para sintetizar carbazoles y β-carbolinas:[13]

Se pueden utilizar métodos de síntesis de indoles para construir carbazoles.
Reacciones
Es una base débil. Se comporta químicamente como una N, N-difenilamina. Los derivados de monosustitución electrofílica aromática se llevan a cabo en la posición 3.[14]
Usos
Es intermediario en la producción de varios pigmentos como el Pigmento violeta 23. Se utiliza en la fabricación de placas fotográficas sensibles a la luz ultravioleta. También se utiliza como reactivo para la lignina, carbohidratos y formaldehído.
Carbazoles naturales
En 1872 Graebe y Glaser fueron los primeros en describir el compuesto padre 9H-carbazol que se obtuvo de la fracción antracénica del destilado de alquitrán de hulla.[15] Noventa años más tarde, la divulgación de las propiedades antimicrobianas de la murrayanina (3-formil-1-metoxicarbazol), aislado de la planta Murraya koenigii despertó un fuerte interés de los químicos y biólogos.[16] Los carbazoles tienen dos precursores biosintéticos principales derivados del ácido antranílico: la 4-hidroxi-2-quinolona y el triptófano.
Los alcaloides carbazólicos de plantas tienen como precursor al 3-metilcarbazol, el cual procede de la prenilación de la 4-hidroxiquinolona.

Estos alcaloides son indicadores quimiotaxonómicos de plantas pertenecientes a la familia Rutaceae (géneros: Murraya, Clausena, Glycosmis) [17][18][19][20][21][22][23][24][25]
| Nombre | R1 | R2 | R3 |
| 3-Metilcarbazol | Me | H | H |
| 3-Formilcarbazol | CHO | H | H |
| Ácido 3-carbazolcarboxílico | COOH | H | H |
| 1-Hidroxi-3-metilcarbazol | Me | H | OH |
| O-Desmetilmurrayanina | CHO | H | OH |
| Clausina E | COOMe | H | OH |
| Murrayafolina A | Me | H | OMe |
| Koenoline | Me | H | OMe |
| Murrayanina | CHO | H | OMe |
| Ácido mukoénico | COOH | H | OMe |
| Mukonina | COOH | H | OMe |
| 2-Hidroxi-3-metilcarbazol | Me | OH | H |
| Mukonal | CHO | OH | H |
| Mukonidina | COOH | OH | H |
| 2-Metoxi-3-metilcarbazol | Me | OMe | H |
| Glicosinina | CHO | OMe | H |
| Clausina L | COOMe | OMe | H |
| Girinimbilol (Mukoenina A) | Me | OH | CH2CH=CMe2 |
| Heptafilina | Me | OH | CH2CH=CMe2 |
Anillos aromáticos relacionados
Referencias
- ↑ Número CAS
- ↑ Merck Index 2001
- ↑ R. Pschorr (1896). «Neue Synthese des Phenanthrens und seiner Derivate». Chem. Ber. 29: 496. doi:10.1002/cber.18960290198.
- ↑ Jerry March (2007). Advanced Organic Chemistry: Reactions, Mechanisms And Structure 6th Edition. New Jersey, US: Wiley. ISBN 978-0-471-72091-1.
- ↑ Review Article, Kenneth K. Laali and Mohammadreza Shokouhimehr, The Pschorr Reaction, a Fresh Look at a Classical Transformation Current Organic Synthesis, 2009, 6, 193-202. DOI:10.2174/157017909788167275
- ↑ Stephen A. Chandler, Peter Hanson, Alec B. Taylor, Paul H. Walton and Allan W. Timms (2001). «Sandmeyer reactions. Part 5.1 Estimation of the rates of 1,5-aryl/aryl radical translocation and cyclisation during Pschorr fluorenone synthesis with a comparative analysis of reaction energetics». J. Chem. Soc., Perkin Trans. 2 (2): 214-228. doi:10.1039/b006184k.
- ↑ W. Borsche (1908). «Ueber Tetra- und Hexahydrocarbazolverbindungen und eine neue Carbazolsynthese. (Mitbearbeitet von. A. Witte und W. Bothe.)». Justus Liebig's Annalen der Chemie 359 (1-2): 49-80. doi:10.1002/jlac.19083590103.
- ↑ E. Drechsel (1888). «Ueber Elektrolyse des Phenols mit Wechselströmen». Journal für praktische Chemie 38 (1): 65-74. doi:10.1002/prac.18880380105.
- ↑ Carl Graebe and Fritz Ullmann (1896). «Ueber eine neue Carbazolsynthese». Justus Liebig's Annalen der Chemie 291 (1): 16-17. doi:10.1002/jlac.18962910104.
- ↑ O. Bremer (1934). «Über die Bedeutung der Graebe-Ullmannschen Carbazolsynthese und deren Übertragung auf N-substituierte Pyridino-triazole». Justus Liebigs Annalen der Chemie 514: 279-291. doi:10.1002/jlac.19345140116.
- ↑ Cadogan, J. I. G.; Cameron-Wood, M.; Mackie, R. K.; Searle, R. J. G. J. Chem. Soc. (1965)pp. 4831.
- ↑ Bucherer, H. T.; Seyde, F. J. Prakt. Chem. (1908):77(2) p. 403.
- ↑ Iwaki, T., Yasuhara, A., and Sakamoto, T., /. Chem. Soc, Perkin Trans. 1, 1999, 1505.
- ↑ Katritzky, A.R., Myong Sang Kim, Fedoseyenko D., Widyan, K., Siskin M., Francisco M. Tetrahedron (2009) V. 65(6) p. 1111-1114
- ↑ Graebe, C.; Glaser, C. Ber. Dtsch. Chem. Ges. (1872) V. 5 p. 12.
- ↑ Chakraborty, D. P.; Barman, B. K.; Bose, P. K. Sci. Cult. (1964) v. 30 p.445.
- ↑ Dewick, P. M. Medicinal Natural Products: A Biosynthetic Approach 3rd ed. (2009) John Wiley & Sons Ltd: Chichester, U.K.
- ↑ (188) Battersby, A. R.; Brown, R. T.; Kapil, R. S.; Plunkett, A. O.;Taylor, J. B. Chem. Commun. (1966) p. 46.
- ↑ Leistner, E.; Zenk, M. H. Tetrahedron Lett. (1968) v.9 p.1395
- ↑ Kureel, S. P.; Kapil, R. S.; Popli, S. P. Experientia (1969) v.25 p. 790.
- ↑ Kong, Y.-C.; Cheng, K.-F.; Ng, K.-H.; But, P. P.-H.; Li, Q.; Yu,S.-X.; Chang, H.-T.; Cambie, R. C.; Kinoshita, T.; Kan, W.-S.;Waterman, P. G. Biochem. Syst. Ecol. (1986) v.14 p.491
- ↑ Eijkman, J. F. Recl. Trav. Chim. Pays−Bas Belg. (1885) v.4, p.32
- ↑ Narasimhan, N. S.; Paradkar, M. V.; Chitguppi, V. P.; Kelkar, S. L. Indian J. Chem. (1975) v.13 p.993.
- ↑ Roy, S.; Guha, R.; Ghosh, S.; Chakraborty, D. P. Indian J. Chem. (1982) v.21B p.617.
- ↑ Kureel, S. P.; Kapil, R. S.; Popli, S. P. J. Chem. Soc. D (1969) p.1120



