
Т — температура; ТА — температура плавления компонента А; ТB — температура плавления компонента В; ТE — эвтектическая температура; ТА—Е и Е—ТB — линии ликвидуса; ТE—Е—ТE — линия солидуса; Е — эвтектическая точка; хB — содержание компонента В в смеси[1]. Принято, что в твёрдом виде компоненты смеси не растворимы один в другом.
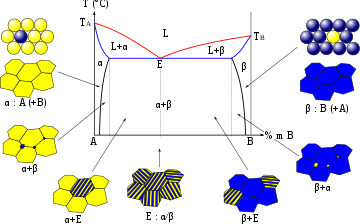

Диаграмма отображает простейший случай, когда три компонента в случае бинарных смесей образуют только простые эвтектики. Для наглядного изображения свойств такой системы строят прямую призму, в основании которой лежит треугольник Гиббса — Розебома; точки треугольника в основании дают состав смесей, а на рёбрах призмы откладывают температуры. Точки отвечают температурам плавления чистых компонентов. Кривые — кривые плавкости бинарных смесей и лежат на грани призмы. — эвтектика бинарной системы . Такими же эвтектиками являются в бинарной системе и в бинарной системе , лежащие на соответствующих гранях призмы. — тройная эвтектика, в которой в равновесии сосуществуют три твёрдые фазы и расплав, и в которой тройная смесь плавится/застывает как одно целое; и — эвтектические кривые.
Эвте́ктика (греч. εύτηκτος — легкоплавкий) — термин, используемый либо:
- для обозначения жидкой гомогенной системы (раствора, расплава) с эвтектическим составом, то есть с составом данной смеси в эвтектической точке (жидкая эвтектика)[2];
- для обозначения твёрдой гетерогенной системы (например, гетерогенного сплава) — продукта затвердевания жидкой эвтектики (твёрдая эвтектика), и дающей после плавления жидкую эвтектику[3];
- как сокращённое название эвтектической точки[3][2].
Общие сведения
Эвтектическая точка — нонвариантная (при постоянном давлении) точка в системе из n компонентов, в которой находятся в термодинамическом равновесии n твёрдых фаз и жидкая фаза. Жидкая эвтектика представляет собой раствор или расплав, кристаллизующийся при температуре более низкой, чем температура кристаллизации каждого из веществ, входящих в состав смеси. Соответственно, температура плавления твёрдой эвтектики — самая низкая для данной смеси компонентов. Это явление как раз и отражает этимология термина.
Термин эвтектика предложил в 1884 году британский физик и химик Фредерик Гётри[4].
В двухкомпонентной (или бинарной) системе эвтектическое равновесие можно выразить:
- где — жидкая фаза (расплав, или раствор, например, «водный раствор»);
- — твёрдый раствор компонента в кристаллической решётке, образованной компонентом ;
- — твёрдый раствор компонента в кристаллической решётке, образованной компонентом .
Добавляя или отводя тепло, можно изменить пропорцию между суммарным объёмом кристаллических фаз и расплавом в эвтектической точке при около эвтектической температуре.
Температура системы при этих процессах будет отличаться от равновесной (в подавляющем большинстве практических случаев очень незначительно — на десятые или сотые доли градуса Цельсия), так как для фазовых превращений (кристаллизации или плавления) необходим термодинамический стимул — переохлаждение или перегрев.
Процесс кристаллизации:
После кристаллизации эвтектика становится смесью кристаллитов фаз (очень часто сильно разветвлённых, взаимно проросших в процессе эвтектической кристаллизации). Одновременное образование нескольких кристаллических фаз в ходе эвтектической кристаллизации обусловливает возможность их кооперативного роста, при выполнении дополнительных условий, — прежде всего, частичной кристаллографической согласованности решёток эвтектических фаз. В результате образуются эвтектические бикристаллы (в случае двухкомпонентных, а также квазибинарных систем) — разветвлённые взаимно вложенные дендриты эвтектических фаз, лишь выглядящие в сечении как мелкодисперсная смесь.
Эвтектика является пересечением поверхностей равновесия расплава с соответствующими (эвтектическими) фазами. Если отводится соответствующее количество тепла, то расплав эвтектического состава при кристаллизации в условиях, близких к равновесным, даст все кристаллические фазы, участвующие в равновесии. Если же подводится тепло в достаточном количестве, то смесь фаз, отвечающая эвтектическому составу, в условиях, близких к равновесным, будет плавиться с одновременным уменьшением доли каждой из кристаллических фаз вплоть до их полного исчезновения.
См. также
- Азеотропная смесь — смеси веществ, обладающие аналогичными свойствами при кипении.
Примечания
- ↑ Киреев В. А., Курс физической химии, 1975, с. 411.
- ↑ 1 2 Эвтектика (БСЭ, 2-е изд.), 1957.
- ↑ 1 2 Эвтектика (Краткая химическая энциклопедия), 1967.
- ↑ Guthrie, Frederick (1884) «On eutexia», Philosophical Magazine, 5th series, 17 : 462—482. From p. 462: Архивная копия от 21 ноября 2018 на Wayback Machine «The main argument of the present communication hinges upon the existence of compound bodies, whose chief characteristic is the lowness of their temperatures of fusion. This property of the bodies may be called Eutexia †, the bodies possessing it eutectic bodies or eutectics (εύ τήκειν).»
Литература
- Аносов В. Я., Озерова М. И., Фиалков Ю. Я. Основы физико-химического анализа. — М.: Наука, 1976. — 504 с.
- Инденбаум Г. В. Эвтектика // Большая советская энциклопедия. — М.: Советская энциклопедия, 1978. — Т. 29. — С. 560.
- Киреев В. А. Курс физической химии. — 3-е изд., перераб. и доп. — М.: Химия, 1975. — 775 с.
- Курнаков Н. С. Введение в физико-химический анализ. — четвертое дополненное. — М.—Л.: Издательство АН СССР, 1940. — 562 с.
- Михайлов В. А. Диаграмма состояния // Химическая энциклопедия. — М.: Большая Российская энциклопедия, 1990. — Т. 2. — С. 32—36.
- Петров Д. А. Двойные и тройные системы. — М.: Металлургия, 1986. — 256 с.
- Сомов А. И., Тихоновский М. А. Эвтектические композиции. — М.: Металлургия, 1975. — 304 с.
- Эвтектика // Большая Советская Энциклопедия (2-е изд). — М.: Советская энциклопедия, 1957. — Т. 48. — С. 315—316.
- Эвтектика // Краткая химическая энциклопедия. — М.: Советская энциклопедия, 1967. — Т. 5. — С. 457 (стб. 913).
- Эвтектика // Большая российская энциклопедия. — Большая Российская энциклопедия, 2017. — Т. 35. — С. 212.
- Юм-Розери В., Христиан Дж., Пирсон В. Диаграммы равновесия металлических систем. — 1956. — 399 с.
Ссылки
Обычно почти сразу, изредка в течении часа.






















