| Хлорид фосфора(V) | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Хлорид фосфора(V) | ||
| Хим. формула | PCl5 | ||
| Рац. формула | PCl5 | ||
| Физические свойства | |||
| Состояние | зеленовато-белый или желтоватый порошок | ||
| Молярная масса | 208,22 г/моль | ||
| Плотность | 2,11[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 160[1] | ||
| • сублимации | 159[1] °C | ||
| Мол. теплоёмк. | 113,32 (газ)[1] Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −376,0[1] кДж/моль | ||
| Давление пара | 1 ± 1 мм рт.ст.[2] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | реагирует | ||
| Классификация | |||
| Рег. номер CAS | 10026-13-8 | ||
| PubChem | 24819 | ||
| Рег. номер EINECS | 233-060-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | TB6125000 | ||
| ChEBI | 30335 | ||
| Номер ООН | 1806 | ||
| ChemSpider | 23204 | ||
| Безопасность | |||
| ЛД50 | 100 мг/кг | ||
| Токсичность | ядовит, сильный окислитель[1] | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Пентахлори́д фо́сфора (хлори́д фо́сфора(V), хлорангидри́д фо́сфорной кислоты, пятихло́ристый фо́сфор) — высший хлорид фосфора, бинарное неорганическое химическое соединение фосфора и хлора с формулой PCl5. Зеленовато-белые[1] или желтоватые[3] кристаллы тетрагональной сингонии с неприятным раздражающим запахом.
Физические свойства
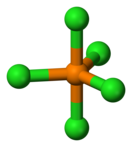
Молекула PCl5 в газообразном или жидком состояниях, а также в неполярных растворителях имеет конфигурацию тригональной бипирамиды (двух треугольных пирамид, соединённых основаниями) с атомом фосфора в основании. Основание является равносторонним треугольником с атомами хлора в вершинах, расстояние между которыми 0,349 нм, а длина связи между ними и атомом фосфора равна 0,202 нм; длина связи P-Cl для двух атомов хлора в вершинах пирамиды (апикальных) равна 0,214 нм. Твёрдый пентахлорид фосфора является ионным кристаллом, он состоит из тетраэдрических ионов [PCl4]+ и октаэдрических ионов [РCl6]−; длина связи P—Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208 нм (апикальные). В полярных растворителях PCl5 диссоциирует на ионы [PCl4]+ и Cl− при низких концентрациях, [PCl4]+ и [РCl6]− при высоких концентрациях[4]
При температуре сублимации плотность паров в 7,2 раза больше плотности воздуха[5]. Давление паров при 20°C равно 1,6 Па (0,012 мм рт.ст.)[6].
Энтальпия сублимации при 390 К равна 67,4 ± 2,3 кДж/моль, при стандартных условиях 71,1 ± 5,0 кДж/моль[7].
Хорошо растворяется в тетрахлоруглероде, несколько хуже — в сероуглероде[1].
Химические свойства
При нагревании выше 300 °C практически полностью разлагается на PCl3 и Cl2[1]. Степень диссоциации при 182 °C равна 41,7%, при 200°C 48,5%, при 250°C 80,0%, при 300°C 97,3%[8].
Пентахлорид фосфора — типичное кислотное соединение. Он энергично реагирует с водой, образуя по первой стадии оксохлорид фосфора(V):
В горячей воде гидролиз протекает полностью, до образования ортофосфорной кислоты:
Для РCl5 характерны реакции окислительного хлорирования:
C концентрированной серной кислотой образует хлорсульфоновую кислоту:
При нагревании РCl5 и NH4Cl происходит реакция образования полимера фосфонитрилхлорида:
(PNCl2)n — прозрачное эластичное вещество, «неорганический каучук». Выдерживает нагревание выше 200 °C. Однако фосфонитрилхлорид сравнительно легко гидролизуется, что затрудняет его практическое использование. Заменой атомов хлора на органические радикалы можно получить водоустойчивые полимеры.
Пентахлорид фосфора является кислотой Льюиса.
Получение
Получают действием избытка хлора на хлорид фосфора(III) в газовой фазе либо пропусканием хлора через раствор PCl3 в сероуглероде:
- (ΔH = 129,7 кДж/моль)[1].
Мировой химической промышленностью, по данным на 2000 год, ежегодно производилось около 10 000 тонн пентахлорида фосфора[9]
Обратная реакция с полным разложением на хлор и трихлорид фосфора происходит при нагревании PCl5 до температуры выше 300 °C[1].
Основные сферы применения
Пятихлористый фосфор является хлорирующим агентом, его используют при получении хлорангидридов фосфорных и фосфоновых кислот из олефинов, в производстве красителей и лекарств[1].
Физиологические свойства
Хлорид фосфора(V) PCl5 является токсичным веществом (сильный неорганический яд) и мощным окислителем. Вызывает ожоги кожи.
ПДК в воздухе 0,2 мг/м3[1]. Класс опасности — 2.
История
Пентахлорид фосфора был впервые синтезирован в 1808 году британским химиком Хэмфри Дэви, который, сжигая фосфор в хлоре, получил прозрачную жидкость (трихлорид фосфора) и белое твёрдое вещество (пентахлорид фосфора)[10]
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 Угай А. Я. Фосфора галогениды // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 147. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ↑ http://www.cdc.gov/niosh/npg/npgd0509.html
- ↑ The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals (англ.) / M. J. O'Neil (ed.). — Whitehouse Station, NJ: Merck and Co., Inc., 2006. — P. 1267.
- ↑ Suter R. W. et al. Nature of Phosphorus(V) Chloride in Ionizing and Nonionizing Solvents (англ.) // Journal of the American Chemical Society. — 1978. — Vol. 95, iss. 5. — P. 1474—1479. — doi:10.1021/ja00786a021.
- ↑ Ellison H. D. Handbook of Chemical and Biological Warfare Agents (англ.). — Baco Raton, FL: CRC Press, 2000. — P. 177.
- ↑ Fee D. C. et al. Phosphorus Compounds // Kirk-Othmer Encyclopedia of Chemical Technology (англ.). — NY: John Wiley & Sons, 2005.
- ↑ Л. Д. Поляченок, О. Г. Поляченок. Диссоциация, сублимация и устойчивость пентахлорида фосфора // Журнал физической химии. — 1973. — Т. 47, вып. 2. — С. 498.
- ↑ Азингер Г. Ф. Химия и технология парафиновых углеводородов. — М.: ГНТИ НГТЛ, 1959. — С. 184.
- ↑ Holleman A. F., Wiber E., Wiberg N. Inorganic Chemistry (англ.). — Academic Press, 2001. — ISBN 978-0-12-352651-9.
- ↑ Davy H. The Bakerian Lecture. An account of some new analytical researches on the nature of certain bodies, particularly the alkalies, phosphorus, sulphur, carbonaceous matter, and the acids hitherto undecomposed; with some general observations on chemical theory (англ.) // Philosophical Transactions of the Royal Society of London. — 1809. — Vol. 99. — P. 39—104. — doi:10.1098/rstl.1809.0005.
Литература
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Реми Г. Курс неорганической химии. — М.: Иностранная литература, 1963.
- Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. — М.: Мир, 1969.
Обычно почти сразу, изредка в течении часа.