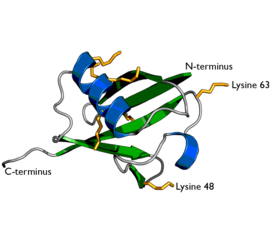
Убиквити́н (от англ. ubiquitous — «вездесущий») — небольшой (8,5 кДа) консервативный белок эукариот, участвующий в регуляции процессов внутриклеточной деградации других белков, а также в модификации их функций. Он присутствует почти во всех тканях многоклеточных эукариот, а также у одноклеточных эукариотических организмов. Убиквитин был открыт в 1975 году Гидеоном Голдштейном с соавторами[1] и охарактеризован в 70—80-х годах XX века[2]. В геноме человека есть четыре гена, кодирующих убиквитин: UBB, UBC, UBA52 и RPS27A[3].
Убиквитинирование — это посттрансляционное присоединение ферментами убиквитинлигазами одного или нескольких мономеров убиквитина с помощью ковалентной связи к боковым аминогруппам белка-мишени. Присоединение убиквитина может оказывать различное воздействие на белки-мишени: оно влияет на внутриклеточную локализацию, оказывает воздействие на их активность, способствует или препятствует белок-белковым взаимодействиям[4][5][6]. Однако первой открытой функцией убиквитина стала протеолитическая деградация белков, помеченных полиубиквитиновыми цепями (в них последующие убиквитиновые звенья присоединяются к боковым аминогруппам предыдущей молекулы убиквитина), с помощью протеасомы 26S. Убиквитин регулирует и такие важные процессы, как пролиферация, развитие и дифференцировка клеток, реакция на стресс и патогены, репарация ДНК.
В 2004 году Аарон Чехановер, Аврам Гершко и Ирвин Роуз были удостоены Нобелевской премии по химии «за открытие убиквитин-опосредованной деградации белка»[7].
История открытия

Убиквитин (первоначально названный ubiquitous immunopoietic polypeptide — повсеместно встречающийся полипептид, ответственный за иммунопоэз) впервые был идентифицирован в 1975 году[1] как белок с неизвестной функцией, имеющий массу 8,5 кДа и присутствующий во всех эукариотических клетках.
Гены убиквитина
У млекопитающих (в том числе, у человека) есть 4 различных гена, кодирующих убиквитин. Каждый из генов UBA52 и RPS27A кодирует единичную копию убиквитина в составе полибелка (полипептида, состоящего из предшественников нескольких белков, которые впоследствии разделяются в результате ограниченного протеолиза перемычек между ними): продукт гена UBA52 первоначально синтезируется как убиквитин, «пришитый» к рибосомному белку L40, а продукт гена RPS27A как убиквитин, «пришитый» к S27a. Гены UBB и UBC кодируют несколько копий убиквитина в составе полибелков-предшественников[3].
Убиквитинирование
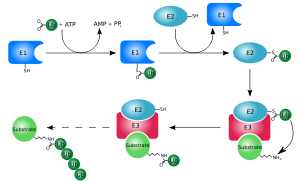
Убиквитинирование (также известное как убиквитилирование) — это ферментативная посттрансляционная модификация (ПТМ), заключающаяся в присоединении убиквитина к белковому субстрату. Чаще всего присоединение происходит с образованием изопептидной связи между карбоксильной группой последнего аминокислотного остатка убиквитина (глицин-76) и аминогруппой боковой цепи остатка лизина белка-субстрата.
Разнообразие убиквитиновых модификаций
Убиквитинирование влияет на клеточные процессы, регулируя деградацию белков (через протеасомы и лизосомы), координируя субклеточную локализацию белков, их активацию и инактивацию и модулируя белок-белковые взаимодействия[4][5][6]. Эти воздействия опосредуются различными типами убиквитинирования белков-субстратов, например, присоединением к субстрату единственной молекулы убиквитина (моноубиквитинирование) или присоединением разнообразных убиквитиновых цепочек (полиубиквитинирование)[8].
Моноубиквитинирование
Моноубиквитинирование — это присоединение одной молекулы убиквитина к белку-субстрату. Множественное моноубиквитинирование (мультиубиквитинирование) — это присоединение нескольких одиночных молекул убиквитина к отдельным остаткам лизина в белке-субстрате. Моноубиквитинирование и полиубиквитинирование одних и тех же белков может иметь для них различные последствия. Считается, что перед образованием полиубиквитиновых цепочек необходимо присоединить единственную молекулу убиквитина[8].
Полиубиквитинирование


Полиубиквитинирование — это образование полиубиквитиновых цепочек на единственном остатке лизина белка-субстрата. После присоединения самого первого остатка убиквитина к белку-субстрату следующие молекулы убиквитина могут присоединяться к первой; в результате образуется полиубиквитиновая цепочка[8]. Эти цепочки формируются посредством образования изопептидной связи между карбоксильной группой С-концевого остатка глицина одной молекулы убиквитина и аминогруппой другой молекулы убиквитина, уже связанной с белком-субстратом. Убиквитин имеет семь остатков лизина и N-конец, которые могут служить точками присоединения последующих молекул убиквитина: это остатки лизина в положениях K6, K11, K27, K29, K33, K48 и K63. Первыми были идентифицированы, и поэтому лучше остальных охарактеризованы, полиубиквитиновые цепочки, образованные связями с остатками лизина-48. Цепочки, связанные через лизин-63, также достаточно полно охарактеризованы, в то время как функция цепочек, связанных через другие остатки лизина, смешанных и разветвлённых цепочек, N-терминальных линейных цепочек и гетерологичных цепочек (состоящих из убиквитина вперемежку с другими убиквитин-подобными белками) остаётся не вполне ясной[8][9][10][11][12].
При помощи полиубиквитиновых цепочек, образованных связью через остаток лизина-48, помечаются белки-мишени, подлежащие протеолитическому распаду.
Полиубиквитиновые цепочки, образованные связью через остаток лизина-63, не связаны с протеасомальной деградацией белка-субстрата. Напротив, эти полиубиквитиновые цепочки играют ключевую роль в координации других процессов, таких как направленный эндоцитоз, воспаление, трансляция и репарация ДНК[13].
Меньше известно об атипичных полиубиквитиновых цепочках (не связанных через остатки лизина-48), но начато исследование, направленное на изучение их роли в клетках[10]. Имеются свидетельства, подтверждающие, что атипичные цепочки, образованные связью через остатки лизина 6, 11, 27, 29, и N-терминальные цепочки могут индуцировать протеасомальную деградацию белков[14][15].
Известно о существовании разветвлённых полиубиквитиновых цепочек, содержащих связи многих типов[16]. Функция этих цепочек неизвестна[17].
Структура полиубиквитиновых цепочек
Полиубиквитиновые цепочки, образованные связями различных типов, оказывают специфичное влияние на белки, к которым они присоединены. Специфика этого влияния обусловлена различиями в конформации белковых цепочек. Полиубиквитиновые цепочки, образованные связями через остатки лизина в положениях 29, 33[18], 63, и N-терминальные цепочки по большей части имеют линейную структуру, известную как «цепочки открытой конформации» (open-conformation chains). Цепочки, образованные связями через остатки K6, K11 и K48, образуют закрытую конформацию (closed conformations). Молекулы убиквитина в линейных цепочках не взаимодействуют друг с другом, за исключением соединяющих их ковалентных изопептидных связей. Напротив, цепочки с закрытой конформацией имеют на своей поверхности остатки аминокислот, способные взаимодействовать друг с другом. При изменении конформации полиубиквитиновых цепочек одни части молекул убиквитина выставляются наружу, а другие скрываются внутри глобул, поэтому различные связи распознаются белками, специфичными по отношению к уникальным топологиям, характерным для данных связей. Белки, связывающие убиквитин, имеют убиквитинсвязывающие домены (англ. Ubiquitin Binding Domains, UBDs). Расстояния между отдельными субъединицами убиквитина в цепочках, образованных связями через лизин-48, и в цепочках, связанных через лизин-63, отличаются друг от друга. Убиквитинсвязывающие белки используют это свойство, чтобы различать разные типы цепочек: более короткие спейсеры между мотивами, взаимодействующими с убиквитином, позволяют связывать лизин-48-связанные (компактные) полиубиквитиновые цепочки, а более длинные — лизин-63-связанные. Существуют механизмы различения линейных цепочек, связанных через лизин-63, и линейных N-терминальными цепочек, о чём свидетельствует тот факт, что линейные N-терминальные цепочки могут индуцировать протеасомальную деградацию белков-субстратов[13][15][17].
|
Литература
- Layfield, Rhonda. The Ubiquitin-Proteasome System (неопр.). — L.: Portland Press, 2005. — ISBN 9781855781535.
Примечания
- ↑ 1 2 Goldstein G., Scheid M., Hammerling U., Schlesinger D. H., Niall H. D., Boyse E. A. Isolation of a polypeptide that has lymphocyte-differentiating properties and is probably represented universally in living cells (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1975. — January (vol. 72, no. 1). — P. 11—5. — doi:10.1073/pnas.72.1.11. — PMID 1078892. — PMC 432229.
- ↑ Wilkinson K. D. The discovery of ubiquitin-dependent proteolysis (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2005. — October (vol. 102, no. 43). — P. 15280—15282. — doi:10.1073/pnas.0504842102. — PMID 16230621. — PMC 1266097.
- ↑ 1 2 Kimura Y., Tanaka K. Regulatory mechanisms involved in the control of ubiquitin homeostasis (англ.) // J Biochem : journal. — 2010. — Vol. 147, no. 6. — P. 793—798. — doi:10.1093/jb/mvq044. — PMID 20418328.
- ↑ 1 2 Glickman M. H., Ciechanover A. The ubiquitin-proteasome proteolytic pathway: destruction for the sake of construction (англ.) // Physiol. Rev. : journal. — 2002. — April (vol. 82, no. 2). — P. 373—428. — doi:10.1152/physrev.00027.2001. — PMID 11917093.
- ↑ 1 2 Mukhopadhyay D., Riezman H. Proteasome-independent functions of ubiquitin in endocytosis and signaling (англ.) // Science : journal. — 2007. — January (vol. 315, no. 5809). — P. 201—205. — doi:10.1126/science.1127085. — PMID 17218518.
- ↑ 1 2 Schnell J. D., Hicke L. Non-traditional functions of ubiquitin and ubiquitin-binding proteins (англ.) // J. Biol. Chem. : journal. — 2003. — September (vol. 278, no. 38). — P. 35857—35860. — doi:10.1074/jbc.R300018200. — PMID 12860974.
- ↑ Lenta.ru: Прогресс: Нобелевскую премию по химии получили израильтяне и американец за исследования белков. Дата обращения: 25 ноября 2010. Архивировано из оригинала 11 ноября 2010 года.
- ↑ 1 2 3 4 Komander D. The emerging complexity of protein ubiquitination (англ.) // Biochem. Soc. Trans. : journal. — 2009. — October (vol. 37, no. Pt 5). — P. 937—953. — doi:10.1042/BST0370937. — PMID 19754430.
- ↑ Peng J., Schwartz D., Elias J. E., Thoreen C. C., Cheng D., Marsischky G., Roelofs J., Finley D., Gygi S. P. A proteomics approach to understanding protein ubiquitination (англ.) // Nature Biotechnology : journal. — Nature Publishing Group, 2003. — August (vol. 21, no. 8). — P. 921—926. — doi:10.1038/nbt849. — PMID 12872131.
- ↑ 1 2 Ikeda F., Dikic I. Atypical ubiquitin chains: new molecular signals. 'Protein Modifications: Beyond the Usual Suspects' review series (англ.) // EMBO Rep. : journal. — 2008. — June (vol. 9, no. 6). — P. 536—542. — doi:10.1038/embor.2008.93. — PMID 18516089. — PMC 2427391.
- ↑ Xu P., Peng J. Characterization of polyubiquitin chain structure by middle-down mass spectrometry (англ.) // Anal. Chem. : journal. — 2008. — May (vol. 80, no. 9). — P. 3438—3444. — doi:10.1021/ac800016w. — PMID 18351785. — PMC 2663523.
- ↑ Kirisako T., Kamei K., Murata S., Kato M., Fukumoto H., Kanie M., Sano S., Tokunaga F., Tanaka K., Iwai K. A ubiquitin ligase complex assembles linear polyubiquitin chains (фр.) // EMBO J. : magazine. — 2006. — Octobre (vol. 25, no 20). — P. 4877—4887. — doi:10.1038/sj.emboj.7601360. — PMID 17006537. — PMC 1618115.
- ↑ 1 2 Miranda M., Sorkin A. Regulation of receptors and transporters by ubiquitination: new insights into surprisingly similar mechanisms (англ.) // Mol. Interv. : journal. — 2007. — June (vol. 7, no. 3). — P. 157—167. — doi:10.1124/mi.7.3.7. — PMID 17609522.
- ↑ Kravtsova-Ivantsiv Y., Ciechanover A. Non-canonical ubiquitin-based signals for proteasomal degradation (англ.) // Journal of Cell Science : journal. — The Company of Biologists, 2012. — February (vol. 125, no. Pt 3). — P. 539—548. — doi:10.1242/jcs.093567. — PMID 22389393.
- ↑ 1 2 Zhao S., Ulrich H. D. Distinct consequences of posttranslational modification by linear versus K63-linked polyubiquitin chains (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2010. — April (vol. 107, no. 17). — P. 7704—7709. — doi:10.1073/pnas.0908764107. — PMID 20385835. — PMC 2867854.
- ↑ Kim H. T., Kim K. P., Lledias F., Kisselev A. F., Scaglione K. M., Skowyra D., Gygi S. P., Goldberg A. L. Certain pairs of ubiquitin-conjugating enzymes (E2s) and ubiquitin-protein ligases (E3s) synthesize nondegradable forked ubiquitin chains containing all possible isopeptide linkages (англ.) // J. Biol. Chem. : journal. — 2007. — June (vol. 282, no. 24). — P. 17375—17386. — doi:10.1074/jbc.M609659200. — PMID 17426036.
- ↑ 1 2 Komander D., Rape M. The ubiquitin code (англ.) // Annu. Rev. Biochem. : journal. — 2012. — Vol. 81. — P. 203—229. — doi:10.1146/annurev-biochem-060310-170328. — PMID 22524316.
- ↑ Michel M. A., Elliot P. R., Swatek K. N., et al. Assembly and Specific Recognition of K29- and K33-Linked Polyubiquitin (англ.) // Mol Cell : journal. — doi:10.1016/j.molcel.2015.01.042. — PMID 25752577.
Ссылки
Обычно почти сразу, изредка в течении часа.