| Параформальдегид | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Полиоксиметилен |
| Хим. формула | (CH2O)n |
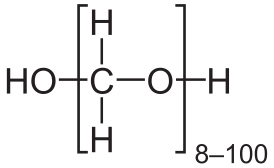
| Рац. формула | OH(CH2O)nH (n = 8—100) |
| Физические свойства | |
| Плотность | 1,42 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 120 °C |
| Классификация | |
| Рег. номер CAS | 30525-89-4 |
| PubChem | 24898648 |
| Рег. номер EINECS | 608-494-5 |
| ChEBI | 31962 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Параформальдеги́д (англ. PFA, также параформ) — продукт полимеризации формальдегида, состоящий из 8—100 мономеров — остатков формальдегида. Параформальдегид обычно имеет легкий запах формальдегида из-за деполимеризации. Параформальдегид является полуацеталем.
Синтез
Параформальдегид медленно образуется в водных растворах формальдегида (формалин) и представляет собой белый осадок. Быстрее образуется на холоде.
Его образование можно рассматривать как результата нуклеофильной атаки кислородным атомом одной молекулы формальдегида карбонильного атома другой молекулы.
nCH2O —" HOCH2-(OCH2)n-2-OCH2OH(n=7,8)
Формалин обычно содержит небольшое количество мономерного формальдегида. Для ингибирования полимеризации растворы формальдегида обычно содержат небольшой процент метанола в качестве стабилизатора.
Реакции
При помощи нагревания в присутствии осушителя параформальдегид подвергается деполимеризации до формальдегида[1] либо до раствора формальдегида в присутствии воды и основания, либо в присутствии воды и при нагревании. Очень чистые растворы формальдегида получают из параформальдегида именно таким путём и используют в качестве фиксирующего вещества в гистологии и цитологии.
Газ, образующийся при нагревании параформальдегида в отсутствие воды, является горючим.
Токсичность
Параформальдегид при хранении выделяет небольшое количество формальдегида и, возможно, является канцерогеном. При оральном введении LD50 для крыс составляет 592 мг/кг.
Примечания
- ↑ Yates, J. Adsorption and decomposition of formaldehyde on tungsten (100) and (111) crystal planes (англ.) // Journal of Catalysis : journal. — 1973. — Vol. 30, no. 2. — P. 260. — doi:10.1016/0021-9517(73)90073-0.
Обычно почти сразу, изредка в течении часа.
