Кетен
| |
|---|---|
Общие
| |
| Хим. формула | C₂H₂O |
Физические свойства
| |
| Молярная масса | 42,037 г/моль |
| Плотность | 1,93 г/см³ |
Термические свойства
| |
| Т. плав. | −150,5 ℃ |
| Т. кип. | −56,1 ℃ |
| Мол. теплоёмк. | 51,75 Дж/(моль·К) |
| Давление пара | > 1 atm (20°C) |
Классификация
| |
| Номер CAS | 463-51-4 |
| PubChem | 10038 |
| ChemSpider | 9643 |
| Номер EINECS | 207-336-9 |
| RTECS | OA7700000 |
| ChEBI | 48003 |
C=C=O
| |
InChI=1S/C2H2O/c1-2-3/h1H2
| |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Кетен (карбометилен, этенон) — H2C=C=O, бесцветный газ с резким запахом. Простейший член гомологического ряда кетенов.
Строение и синтез
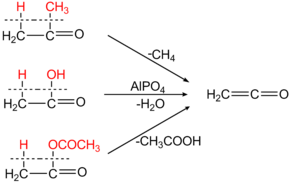
Первоначально основным лабораторным методом синтеза кетена являлся пиролиз ацетона в специальном аппарате — «кетеновой лампе» с выходами от 25-29 % в случае внешнего нагрева[1] до 80-90 % в кетеновых лампах с внутренним электрическим нагревом[2]. Этот метод также используется для синтеза некоторых гомологов кетена, например, метилкетена из метилэтилкетона[3].
Кетен также может быть синтезирован пиролизом уксусного ангидрида или уксусной кислоты:
Кетен также образуется при действии цинка на раствор бромацетилбромида в эфире[4]:
- BrCH2COBr + Zn CH2=C=O + ZnBr2
Отщепление галогеноводорода сильными основаниями от ацеталей галогенуксусных альдегидов является препаративным методом синтеза диалкилкеталей кетена[5]:
- BrCH2CH(OEt)2 CH2=C(OEt)2 + HBr
В настоящее время благодаря доступности промышленно синтезируемого дикетена кетен обычно получают его пиролизом[2].
Промышленный синтез и применение
Кетен является крупнотоннажным продуктом промышленного органического синтеза (мощности США и Западной Европы в 1995 г. — 550 тыс. тонн), большая часть используется для производства уксусного ангидрида ацилированием уксусной кислоты[6]. В промышленности кетен получают пиролизом уксусной кислоты в присутствии триэтилфосфата или пиролизом ацетона над глинозёмом.
Кетен также используется в промышленном синтезе в реакциях [2+2]-циклоприсоединения к альдегидам.
Циклоприсоединение кетена к хлоралю с образованием соответствующего трихлорметил-β-лактона и последующим его гидролизом используется как метод синтеза яблочной кислоты, в модификации процесса, использующей в качестве хиральных индукторов на стадии [2+2]-циклоприсоединения хинина или хинидина позволяет провести реакцию стереоселективно с образованием (S)-(-)-яблочной кислоты, при этом достигает 96 %, оптическая чистота — 95 %[7].
Кетен также используется для производства капролактама (процесс Techni-Chem). На первой стадии этого процесса кетеном ацилируют циклогексанон с образованием циклогексенилацетата, который затем нитруют с отщеплением уксусной кислоты, получая 2-нитроциклогексанон. 2-Нитроциклогексанон затем подвергается гидролизу с образованием ε-нитрокапроновой кислоты, которую восстанавливают до ε-аминокапроновой кислоты; последнюю дегидратируют в капролактам при 300 °C и давлении 100 бар. Главным преимуществом Techni-Chem процесса является минимизация образования побочных продуктов, отщепляющаяся при нитровании циклогексенилацетата может быть пиролизована в кетен[8].
Реакционная способность и производные
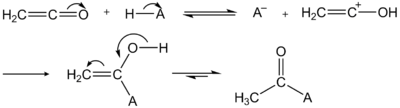
Кетен, формально являющийся внутренним ангидридом уксусной кислоты, очень реакционноспособен и является сильным ацилирующим агентом, легко присоединяющимся к нуклеофильным молекулам с образованием ацетильных производных:
- , где Х — Hal, OH, OR, OCOR, NH2, NHR, SH, SR и т. д.
Реакция идет через образование енольного аддукта, который затем таутомеризуется в ацетильное производное:
Кетен вступает в реакции [2+2]-циклоприсоединения, сам кетен димеризуется по этому механизму в дикетен при температуре выше −80 °C:
С алкенами кетен реагирует с образованием циклобутенонов.
Токсичность
Кетен — прозрачный газ с резким запахом, вызывающий раздражение глаз и дыхательных путей, чем напоминает фосген. При длительном воздействии возможен отёк лёгких.
Примечания
- ↑ KETENE (англ.) // Organic Syntheses : journal. — 1925. — Vol. 4. — P. 39. — ISSN 23333553 00786209, 23333553. — doi:10.15227/orgsyn.004.0039. Архивировано 26 декабря 2015 года.
- ↑ 1 2 Williams, Jonathan W.; Hurd, Charles D. An improved apparatus for the laboratory preparation of ketene and butadiene (англ.) // The Journal of Organic Chemistry : journal. — 1940. — Vol. 05, no. 2. — P. 122—125. — ISSN 0022-3263. — doi:10.1021/jo01208a005.
- ↑ Streith, Jacques; Tschamber, Théophile. Methylketen: Herstellung durch Pyrolyse von Butanon und Reaktion mit Iminen unter Bildung von methylierten Azetidinonen (нем.) // Liebigs Annalen der Chemie : magazin. — 1983. — Bd. 1983, Nr. 8. — S. 1393—1408. — ISSN 1099-0690. — doi:10.1002/jlac.198319830811.
- ↑ Staudinger, H.; Klever, H. W. Über Ketene. 6. Mitteilung: Keten (нем.) // Berichte der deutschen chemischen Gesellschaft : magazin. — 1908. — Bd. 41, Nr. 1. — S. 594—600. — ISSN 1099-0682. — doi:10.1002/cber.190804101112. Архивировано 25 декабря 2015 года.
- ↑ KETENE DIETHYLACETAL (англ.) // Organic Syntheses : journal. — 1943. — Vol. 23. — P. 45. — ISSN 23333553 00786209, 23333553. — doi:10.15227/orgsyn.023.0045.
- ↑ Weissermel, Klaus; Arpe, Hans-Jürgen. Industrial Organic Chemistry (неопр.). — John Wiley & Sons, 2003. — С. 182. — ISBN 978-3-527-30578-0.
- ↑ Wyatt, Paul; Warren, Stuart. Organic Synthesis: Strategy and Control (неопр.). — John Wiley & Sons, 2013. — С. 587. — ISBN 978-1-118-68144-2.
- ↑ Weissermel, Klaus; Arpe, Hans-Jürgen. Industrial Organic Chemistry (неопр.). — John Wiley & Sons, 2003. — С. 258. — ISBN 978-3-527-30578-0.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5.
- О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.
Обычно почти сразу, изредка в течении часа.