| Гексановая (капроновая) кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Гексановая кислота | ||
| Традиционные названия | Капроновая кислота | ||
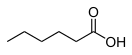
| Хим. формула | C6H12O2 | ||
| Рац. формула | СH3(CH2)4СООН | ||
| Физические свойства | |||
| Молярная масса | 116,15828 г/моль | ||
| Плотность | 0,920 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -3,4 °C | ||
| • кипения | 202-203 °C | ||
| • вспышки | 102 °C | ||
| • самовоспламенения | 380 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 4,88 | ||
| Растворимость | |||
| • в метанол | 7,98 М | ||
| Оптические свойства | |||
| Показатель преломления | 1.4170 | ||
| Классификация | |||
| Рег. номер CAS | 142-62-1 | ||
| PubChem | 8892 | ||
| Рег. номер EINECS | 205-550-7 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 30776 | ||
| ChemSpider | 8552 | ||
| Безопасность | |||
| ЛД50 | 3000 мг/кг | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Капро́новая кислота́ (гекса́новая кислота, химическая формула — С6Н12О2 или С5Н11COOH) — cлабая химическая органическая кислота, относящаяся к классу предельных карбоновых кислот.
При стандартных условиях, капроновая кислота — это одноосновная карбоновая кислота, представляющая собой бесцветную жидкость с неприятным запахом.
Соли и анионы капроновой кислоты называют капрона́тами.
Изомерия
Наряду с капроновой кислотой существует еще 7 структурных изомеров общей формулы С5Н11COOH:
- 4-метилпентановая кислота: СН3-СН(СН3)-СН2-СН2-COOH
- 3-метилпентановая кислота: СН3-СН2-СН(СН3)-СН2-COOH
- 2-метилпентановая кислота: СН3-СН2-СН2-СН(СН3)-COOH
- 2-этилбутановая кислота: СН3-СН2-СН(СН2-СН3)-COOH
- 3,3-диметилбутановая кислота: СН3-С(СН3)2-СН2-COOH
- 2,2-диметилбутановая кислота: СН3-СН2-С(СН3)2-COOH
- 2,3-диметилбутановая кислота: СН3-СH(СН3)-СH(СН3)-COOH
и 5 изомеров межклассовой изомерии:
- Метиловый эфир валериановой кислоты (метилвалерианат): СН3-СН2-СН2-СН2-СOO-СН3
- Этиловый эфир масляной кислоты (этилбутират): СН3-СН2-СН2-СOO-СН2-СН3
- Пропиловый эфир пропионовой кислоты (пропилпропионат): СН3-СН2-СOO-СН2-СН2-СН3
- Бутиловый эфир уксусной кислоты (бутилацетат): СН3-СOO-СН2-СН2-СН2-СН3
- Пентиловый эфир муравьиной кислоты (пентилформиат): СOO-СН2-СН2-СН2-СН2-СН3
Физические свойства
Капроновая кислота — это бесцветная маслянистая жидкость с неприятным запахом. Плохо растворима в воде 9.68 г/л (20°С), 11.71 г/л (60)°С. Хорошо растворима в метаноле, этаноле, эфире.
Химические свойства
По химическим свойствам капроновая кислота — это типичный представитель насыщенных алифатических карбоновых кислот. Кислота средней силы (pKa 4.88). Образует соли и сложные эфиры, галогенангидриды и ангидрид. Бромируется в α-положение бромом в присутствии фосфора.
Получение и нахождение в природе
В природе эфиры капроновой кислоты находятся в различных животных жирах и в масле пальмы бабассу (0,2%). Содержится в древесине Goupia glabra (=tomentosa); может быть получена: из нитрила — Н3С[СH2]4CN, окислением нормального гексанола, окислением содержащейся в клещевинном масле рицинолевой кислоты; образуется при брожении сахара в присутствии гнилого сыра, почему и является побочным продуктом при маслянокислом брожении; из фибрина она образуется под влиянием стрептококков. Входит в состав молочных жиров (3.6—7.2 %). Для добывания рекомендуется фракционировка сырой масляной кислоты, связанная с промыванием фракций водой (масляная кислота сравнительно растворимее).
Применение
Используется для получения сложных эфиров, применяемых в качестве ароматизаторов. Для получения гексилфенолов.
Безопасность
Температура вспышки — 102°С, температура самовоспламенения — 380°С. Пределы взрываемости 1.3—9.3%. ПДК 5 мг/м3. ЛД50 — 3000 мг/кг (крысы перорально).
Литература
- Капроновая кислота // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Химическая энциклопедия, Т2. Под ред. Кнунянца Л.И. - М.: Советская энциклопедия, 1990. - С.616
Обычно почти сразу, изредка в течении часа.