| L-глутамат-аммиак лигаза | |
|---|---|
![Активный центр между двумя мономерами глутаминсинтетазы Salmonella typhimurium. Сайты связывания катионов окрашены в жёлтый и оранжевый цвета; АДФ — розовый; фосфинотрицин (необратимый ингибитор) имеет синий цвет.[1]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/69/MN_MN_ADP_PPQ.png/274px-MN_MN_ADP_PPQ.png) Активный центр между двумя мономерами глутаминсинтетазы Salmonella typhimurium. Сайты связывания катионов окрашены в жёлтый и оранжевый цвета; АДФ — розовый; фосфинотрицин (необратимый ингибитор) имеет синий цвет.[1] | |
| Идентификаторы | |
| Шифр КФ | 6.3.1.2 |
| Номер CAS | 9023-70-5 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9023-70-5 |
| Глутаминсинтетаза, каталитический домен | |
|---|---|
![12-субъединичный фермент глутаминсинтетаза из Salmonella typhimurium.[2]](/wikipedia/commons/thumb/3/30/PDB_2gls_EBI.jpg/274px-PDB_2gls_EBI.jpg) 12-субъединичный фермент глутаминсинтетаза из Salmonella typhimurium.[2] | |
| Идентификаторы | |
| Символ | Gln-synt_C |
| Pfam | PF00120 |
| Pfam clan | CL0286 |
| InterPro | IPR008146 |
| PROSITE | PDOC00162 |
| SCOP | 2gls |
| SUPERFAMILY | 2gls |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Глутаминсинтетаза, также L-глутамат-аммиак лигаза (сокр. ГС) — фермент (КФ 6.3.1.2)[3] из класса синтетаз (лигаз), принимает участие в обезвреживании свободного аммиака в тканях. Данный фермент катализирует в присутствии двухвалентных ионов (Mg2+ или Mn2+) реакцию образования аминокислоты L-глутамина, посредством присоединения к L-глутамату молекул аммиака NH3 (in vivo свободный аммиак ионизирован и представляет собой катион аммония — NH4+), с использованием энергии гидролиза макроэргических связей АТФ. Реакция имеет следующий вид:
L-глутамат + ATФ + NH3 → L-глутамин + АДФ + Фi.

Глутаминсинтетаза использует в качестве субстрата аммиак (точнее ионы аммония), образующийся в результате восстановления нитратов, расщепления аминокислот и фотодыхания[4](у растений). Амидная группа глутамата является источником азота для синтеза метаболитов глутаминового пути[5](например, для синтеза пиримидиновых азотистых оснований).
Конкуренция между ионом аммония и водой, их сродство к связыванию и концентрация иона аммония влияют на синтез глутамина и его гидролиз. Глутамин образуется, если ион аммония атакует ацилфосфатный промежуточный продукт, в то же время, если вода атакует молекулы интермедиата, то происходит образование глутамата[6][7]. Ион аммония связывается с ГС сильнее, чем вода, из-за электростатических сил между катионом и отрицательно заряженным карманом[4]. Другая возможная реакция заключается в том, что при связывании гидроксиламина NH2OH с ГС, а не с ионом NH4+, образуется γ-глутамилгидроксамат[6][7].
Глутаминсинтетаза широко распространена в живых организмах и встречается как у прокариот, так и у эукариот. Прокариотические типы глутаминсинтетазы локализованы в цитозоле клеток, в то же время эукариотические типы фермента могут располагаться как в цитозоле, так и в органеллах (в митохондриях или хлоропластах). Несмотря на то, что данный фермент обнаружен в матриксе митохондрий, ГС — не является митохондриальным белком, он транслоцируется в матрикс обычно из цитозоля.
У человека ГС кодируется геном — GLUL, который локализован на q-плече 1-ой хромосомы. Длина полипептидной цепи белка составляет 373 аминокислотных остатков, его молекулярная масса — 42064 Да[8]. Белок имеет 2 домена: первый домен — некаталитический (β-grasp), включает аминокислоты 24-106, второй — каталитический, включает в себя аминокислоты 113-373.
Структура
Глутаминсинтетаза представляет собой олигомерный белок и может состоять из 8, 10 или 12 идентичных субъединиц, разделённых на два обращённых друг к другу кольца[6][9][10][11]. Бактериальные ГС представляют собой додекамеры (12-меры) с 12 активными центрами между каждым мономером[6]. Каждый активный сайт создаёт «туннель», который является местом расположения трёх различных сайтов связывания субстрата: нуклеотида, иона аммония (NH4+) и аминокислоты[4][6][11][12]. Молекулы АТФ связываются с верхушкой двойной воронки, которая открывается на внешнюю поверхность ГС. Глутамат связывается в нижней части активного сайта[7]. В середине двойной воронки имеются два места связывания двухвалентных катионов (Mn+2 или Mg+2). Один сайт связывания катионов участвует в фосфорильном переносе АТФ на глутамат, а второй стабилизирует активность ГС и помогает связыванию глутамата[6].
Два кольца ГС удерживаются вместе за счёт водородных связей и гидрофобных взаимодействий. В своей последовательности каждая субъединица имеет С-конец и N-конец. С-конец (спиральный ремешок) стабилизирует структуру глутаминсинтетазы, встраиваясь в гидрофобную область субъединицы поперёк другого кольца. N-конец подвергается воздействию растворителя. Кроме того, центральный канал формируется за счёт шести четырёхцепочечных β-листов, состоящих из антипараллельных петель двенадцати субъединиц[6].

Механизм катализа
Фермент катализирует АТФ-зависимую конденсацию глутамата с аммиаком с образованием глутамина[4]. Гидролиз молекул АТФ запускает первый этап двухступенчатого согласованного механизма[4][6]. АТФ фосфорилирует глутамат с образованием АДФ и промежуточного ацилфосфата — γ-глутамилфосфата, который реагирует с аммиаком, образуя глутамин и неорганический фосфат. АДФ и Фi не диссоциируют до тех пор, пока происходит связывания аммиака и не высвобождается глутамин[6].
АТФ сначала связывается с верхней частью активного сайта, расположенного рядом с сайтом связывания катионов, тогда как глутамат связывается со вторым сайтом связывания катионов в нижней части активного сайта[5][7]. Присутствие молекул АДФ вызывает конформационный сдвиг в молекуле фермента, который стабилизирует фрагмент γ-глутамилфосфата. Аммоний прочно связывается с ГС только в том случае, если присутствует промежуточный ацилфосфат. Аммоний, а не аммиак, связывается с ГС, поскольку сайт связывания полярен и подвергается воздействию растворителя[7]. На втором этапе депротонирование аммония позволяет аммиаку атаковать интермедиат из близлежащего участка с образованием глутамина[13]. Фосфат (Фi) уходит через верхнюю часть активного центра, а глутамин — через нижнюю часть (между двумя кольцами)[14][7].
Биологические функции
ГС локализована преимущественно в головном мозге, почках и печени[4][11]. Глутаминсинтетаза в головном мозге участвует в метаболической регуляции глутамата, детоксикации аммиака (который очень токсичен для ЦНС), ассимиляции аммиака, рециклизации нейротрансмиттеров и прекращении сигналов нейромедиаторов[4][15]. ГС в головном мозге обнаруживается преимущественно в астроцитах[16]. Астроциты защищают нейроны от эксайтотоксичности, поглощая избыток аммиака и глутамата. В гипераммониемической среде (высокие концентрации аммиака) возникает отёк астроглии[15][17][18]. К проблеме набухания астроглии подошли с разных точек зрения. Одно исследование показывает, что происходят морфологические изменения, которые увеличивают экспрессию ГС в глутаматергических областях или другие адаптации, которые снижают высокие уровни глутамата и аммиака[15]. Другая точка зрения заключается в том, что набухание астроцитов происходит из-за накопления глутамина. Чтобы предотвратить повышение уровня коркового глутамата и содержания кортикальной воды, было проведено исследование по предотвращению активности ГС у крыс с помощью ингибитора — метионинсульфоксимина (MSO)[17].
Классы
По-видимому, существует три различных класса ГС:[19][20][21]
- Ферменты класса I (GSI) специфичны для прокариот и представляют собой олигомеры из 12 идентичных субъединиц[22]. Активность фермента GSI-типа контролируется аденилированием остатка тирозина. Аденилированный фермент неактивен[23].
- Ферменты класса II (GSII) обнаружены у эукариот и бактерий, принадлежащих к семействам Rhizobiaceae, Frankiaceae и Streptomycetaceae (эти бактерии также имеют GS класса I). GSII являются декамерами, состоящими из 10 идентичных субъединиц[11]PDB 2OJW.
Растения имеют два или более изофермента GSII, один из изоферментов транслоцируется в хлоропласт. Другая форма — цитозольная. Цитозольная трансляция гена GS регулируется его 5'-нетранслируемой областью (5'-UTR), в то время как его 3'-UTR играет роль в смене транскриптов[24].
- Ферменты класса III (GSIII) в настоящее время обнаружены только у Bacteroides fragilis и Butyrivibrio fibrisolvens. Это додекамер (12-мер) с двойным кольцом из одинаковых цепочек[25]. Глутаминсинтетазы данного класса намного крупнее (около 700 аминокислот), чем ферменты GSI (от 450 до 470 аминокислот) или GSII (от 350 до 420 аминокислот).
Хотя три класса глутаминсинтетаз явно структурно связаны, их сходство последовательностей не столь велико.
Регуляция и ингибирование
ГС подвержена обратимой ковалентной модификации. Аминокислотный остаток тирозина Tyr-397 из всех 12 субъединиц может подвергаться аденилированию или деаденилированию аденилаттрансферазой (AT), бифункциональным регуляторным ферментом[26]. Аденилирование — это посттрансляционная модификация белка, включающая ковалентное присоединение молекул АМФ к боковой цепи белка. Для каждого аденилирования требуется молекула АТФ, а для полного ингибирования ГС требуется 12 АТФ. Деаденилирование с помощью АТ включает фосфоролитическое удаление Tyr-связанных аденилильных групп в виде молекул АДФ. На активность АТ влияет связанный с ней регуляторный белок: PII, тример с молекулярной массой 44 кДа[26]. PII также подвергается посттрансляционной модификации уридилилтрансферазой, поэтому PII имеет две формы. Состояние белка PII влияет на активность аденилаттрансферазы. Если PII не уридилирован, то он примет форму PIIA. Комплекс AT:PIIA деактивирует ГС путём аденилирования. Если молекулы PII уридилированы, то они примут форму PIID. Комплекс AT:PIID активирует ГС путём деаденилирования[26]. Комплексы AT:PIIA и AT:PIID реципрокно (взаимно) аллостерически регулируются α-кетоглутаратом (α-KG) и глутамином (Gln). Gln активирует активность AT:PIIA и ингибирует AT:PIID, что приводит к аденилированию и последующей дезактивации ГС. Более того, Gln выступает за преобразование PIID в PIIA. Эффекты α-KG на комплексы противоположны[26]. У большинства грамотрицательных бактерий глутаминсинтетаза может модифицироваться путём аденилирования (некоторые цианобактерии и зелёные водоросли или исключения)[27].
Ингибирование ГС в основном сосредоточено на связывании сайтов амино лигандов[6]. Другие ингибиторы являются результатом метаболизма глутамина: триптофан, гистидин, карбамоилфосфат, глюкозамин-6-фосфат, цитидинтрифосфат (ЦТФ) и аденозинмонофосфат (АМФ)[5][9][28]. Другими ингибиторами/регуляторами являются аминокислоты глицин и аланин. Аланин, глицин и серин связываются с участком глутаматного субстрата. ГДФ, АМФ, АДФ связываются с сайтом АТФ[6]. L-серин, L-аланин и глицин связываются с сайтом L-глутамата в неаденилированной глутаминсинтетазе. Четыре аминокислоты связываются с этим участком своими общими атомами, “главной цепью” аминокислот[5]. Глутамат — ещё один продукт метаболизма глутамина; однако глутамат является субстратом для ингибирования ГС, который действует как регулятор ГС. Каждый ингибитор может снижать активность фермента; как только все конечные метаболиты глутамина связываются с ферментом, его активность почти полностью ингибируется[9]. Множество ингибирующих входных сигналов позволяет осуществлять тонкую регуляцию ГС, отражая уровень азота в организме.
Регуляция обратной связи определяет разницу между двумя эукариотическими типами ГС: мозговым типом (ткани мозга) и немозговым (все остальные ткани). Немозговой тип ГС реагирует на подавление обратной связи конечным продуктом, в то время как мозговой тип ГС этого не делает[6]. Высокие концентрации глутамин-зависимых метаболитов должны подавлять активность ГС, в то время как низкие концентрации должны активировать активность ГС.
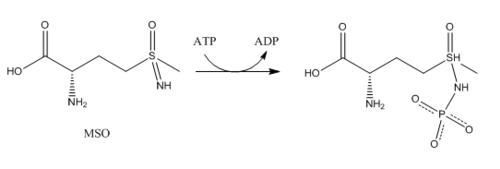
Ингибиторы:
- Метионинсульфоксимин (МСО, MSO): МСО является ингибитором, который связывается с глутаматным участком. Связанный с глутаминсинтетазой, MSO фосфорилируется АТФ, что приводит к необратимому нековалентному ингибированию ГС. МСО, имеющий конфигурацию S-изомера является более сильным ингибитором. Поступление глутамата в активный центр блокируется стабилизацией гибкой петли в активном центре с помощью МСО[7].
- Фосфинотрицин (PPT, глуфосинат): Фосфинотрицин является ингибитором, который связывается с глутаматным участком. Глуфосинат используется в качестве гербицида. Обработанные глуфосинатом растения погибают из-за накопления аммиака и прекращения фотосинтеза[11].
- Сегодня доступно множество синтетических ингибиторов[6].
Исследования на E. coli показали, что глутаминсинтетаза регулируется посредством экспрессии генов. Ген, кодирующий субъединицу ГС, обозначается glnA. Транскрипция glnA зависит от NRI (специфического усилителя транскрипции). Активная транскрипция происходит, если NRI находится в своей фосфорилированной форме, обозначаемой NRI-P. Фосфорилирование NRI катализируется NRII, протеинкиназой. Если NRII образует комплекс с PIIA, то он будет функционировать как фосфатаза, и NRI-P преобразуется обратно в NRI. В этом случае транскрипция glnA прекращается[26].
ГС подчиняется совершенно иным регуляторным механизмам у цианобактерий[29]. Вместо обычной двухкомпонентной системы NtrC-NtrB[30][31], цианобактерии содержат регулятор транскрипции NtcA, который ограничен этой кладой и контролирует экспрессию ГС и множества генов, участвующих в метаболизме азота[32][33]. Более того, глутаминсинтетазы у цианобактерий ковалентно не модифицируется чтобы повысить чувствительность к ингибированию по принципу обратной связи[31]. Вместо этого, ГС у цианобактерий ингибируются небольшими белками, которые называются ГС-инактивирующими факторами (IFs), транскрипция которых отрицательно регулируется NtcA[34][35]. Кроме того, эти инактивирующие факторы регулируются различными некодирующими РНК: sRNA NsiR4 взаимодействует с 5'-UTR мРНК фактора инактивации ГС IF7 (мРНК gifA) и снижает его экспрессию. Экспрессия NsiR4 находится под положительным контролем транскрипционного фактора, отвечающего за регуляцию азота, NtcA[36]. Кроме того, экспрессия фактора, инактивирующего ГС, IF17 контролируется глутамин-связывающим рибопереключателем[37].
Примечания
- ↑ PDB 1FPY; Gill HS, Eisenberg D (February 2001). "The crystal structure of phosphinothricin in the active site of glutamine synthetase illuminates the mechanism of enzymatic inhibition". Biochemistry. 40 (7): 1903—12. doi:10.1021/bi002438h. PMID 11329256.
- ↑ PDB 2GLS; Yamashita MM, Almassy RJ, Janson CA, Cascio D, Eisenberg D (October 1989). "Refined atomic model of glutamine synthetase at 3.5 A resolution". J. Biol. Chem. 264 (30): 17681—90. doi:10.2210/pdb2gls/pdb. PMID 2572586.
- ↑ Eisenberg D, Almassy RJ, Janson CA, Chapman MS, Suh SW, Cascio D, Smith WW (1987). "Some evolutionary relationships of the primary biological catalysts glutamine synthetase and RuBisCO". Cold Spring Harb. Symp. Quant. Biol. 52: 483—90. doi:10.1101/sqb.1987.052.01.055. PMID 2900091.
- ↑ 1 2 3 4 5 6 7 Liaw SH, Kuo I, Eisenberg D (Nov 1995). "Discovery of the ammonium substrate site on glutamine synthetase, a third cation binding site". Protein Sci. 4 (11): 2358—65. doi:10.1002/pro.5560041114. PMC 2143006. PMID 8563633.
- ↑ 1 2 3 4 Liaw SH, Pan C, Eisenberg D (Jun 1993). "Feedback inhibition of fully unadenylylated glutamine synthetase from Salmonella typhimurium by glycine, alanine, and serine". Proc. Natl. Acad. Sci. USA. 90 (11): 4996—5000. Bibcode:1993PNAS...90.4996L. doi:10.1073/pnas.90.11.4996. PMC 46640. PMID 8099447.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 Eisenberg D, Gill HS, Pfluegl GM, Rotstein SH (Mar 2000). "Structure-function relationships of glutamine synthetases". Biochim Biophys Acta. 1477 (1—2): 122—45. doi:10.1016/S0167-4838(99)00270-8. PMID 10708854. Архивировано 16 апреля 2023. Дата обращения: 12 октября 2023.
- ↑ 1 2 3 4 5 6 7 Liaw SH, Eisenberg D (Jan 1994). "Structural model for the reaction mechanism of glutamine synthetase, based on five crystal structures of enzyme-substrate complexes". Biochemistry. 33 (3): 675—81. doi:10.1021/bi00169a007. PMID 7904828.
- ↑ UniProt, P15104 (англ.). Дата обращения: 14 октября 2023. Архивировано 16 октября 2023 года.
- ↑ 1 2 3 Biochemistry. — 6th. — San Francisco : W.H. Freeman, 2007. — P. 679–706. — ISBN 978-0-7167-8724-2.
- ↑ Goodsell DS. Glutamine Synthetase. Molecule of the month. RCSB Protein Data Bank (июнь 2002). Дата обращения: 8 мая 2010. Архивировано из оригинала 31 мая 2008 года.
- ↑ 1 2 3 4 5 Krajewski WW, Collins R, Holmberg-Schiavone L, Jones TA, Karlberg T, Mowbray SL (Jan 2008). "Crystal structures of mammalian glutamine synthetases illustrate substrate-induced conformational changes and provide opportunities for drug and herbicide design". J Mol Biol. 375 (1): 317—28. doi:10.1016/j.jmb.2007.10.029. PMID 18005987.
- ↑ Ginsburg A, Yeh J, Hennig SB, Denton MD (Feb 1970). "Some effects of adenylylation on the biosynthetic properties of the glutamine synthetase from Escherichia coli". Biochemistry. 9 (3): 633—49. doi:10.1021/bi00805a025. PMID 4906326.
- ↑ Hunt JB, Smyrniotis PZ, Ginsburg A, Stadtman ER (Jan 1975). "Metal ion requirement by glutamine synthetase of Escherichia coli in catalysis of gamma-glutamyl transfer". Arch Biochem Biophys. 166 (1): 102—24. doi:10.1016/0003-9861(75)90370-7. PMID 235885.
- ↑ Goodsell, DS. Glutamine Synthetase. RCSB Protein Data Bank (июнь 2002). Дата обращения: 8 мая 2010. Архивировано из оригинала 31 мая 2008 года.
- ↑ 1 2 3 Suarez I, Bodega G, Fernandez B (Aug-Sep 2002). "Glutamine synthetase in brain: effect of ammonia". Neurochem. Int. 41 (2—3): 123—42. doi:10.1016/S0197-0186(02)00033-5. PMID 12020613. S2CID 24661063.
{{cite journal}}: Википедия:Обслуживание CS1 (формат даты) (ссылка) - ↑ Venkatesh K, Srikanth L, Vengamma B, Chandrasekhar C, Sanjeevkumar A, Mouleshwara Prasad BC, Sarma PV (2013). "In vitro differentiation of cultured human CD34+ cells into astrocytes". Neurol India. 61 (4): 383—8. doi:10.4103/0028-3886.117615. PMID 24005729. Архивировано 17 апреля 2023. Дата обращения: 12 октября 2023.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ 1 2 Willard-Mack CL, Koehler RC, Hirata T, et al. (March 1996). "Inhibition of glutamine synthetase reduces ammonia-induced astrocyte swelling in rat". Neuroscience. 71 (2): 589—99. doi:10.1016/0306-4522(95)00462-9. PMID 9053810. S2CID 31674240.
- ↑ Tanigami H, Rebel A, Martin LJ, Chen TY, Brusilow SW, Traystman RJ, Koehler RC (2005). "Effect of glutamine synthetase inhibition on astrocyte swelling and altered astroglial protein expression during hyperammonemia in rats". Neuroscience. 131 (2): 437—49. doi:10.1016/j.neuroscience.2004.10.045. PMC 1819407. PMID 15708485.
- ↑ Kumada Y, Benson DR, Hillemann D, Hosted TJ, Rochefort DA, Thompson CJ, Wohlleben W, Tateno Y (April 1993). "Evolution of the glutamine synthetase gene, one of the oldest existing and functioning genes". Proc. Natl. Acad. Sci. U.S.A. 90 (7): 3009—13. Bibcode:1993PNAS...90.3009K. doi:10.1073/pnas.90.7.3009. PMC 46226. PMID 8096645.
- ↑ Shatters RG, Kahn ML (November 1989). "Glutamine synthetase II in Rhizobium: reexamination of the proposed horizontal transfer of DNA from eukaryotes to prokaryotes". J. Mol. Evol. 29 (5): 422—8. Bibcode:1989JMolE..29..422S. doi:10.1007/BF02602912. PMID 2575672. S2CID 36704558.
- ↑ Brown JR, Masuchi Y, Robb FT, Doolittle WF (June 1994). "Evolutionary relationships of bacterial and archaeal glutamine synthetase genes". J. Mol. Evol. 38 (6): 566—76. Bibcode:1994JMolE..38..566B. doi:10.1007/BF00175876. PMID 7916055. S2CID 21493521.
- ↑ GSI structure. Дата обращения: 31 марта 2009. Архивировано из оригинала 17 декабря 2008 года.
- ↑ InterPro:IPR001637 Glutamine synthetase class-I, adenylation site. Дата обращения: 12 октября 2023. Архивировано 11 апреля 2023 года.
- ↑ Ortega JL, Wilson OL, Sengupta-Gopalan C (December 2012). "The 5' untranslated region of the soybean cytosolic glutamine synthetase β(1) gene contains prokaryotic translation initiation signals and acts as a translational enhancer in plants". Molecular Genetics and Genomics. 287 (11—12): 881—93. doi:10.1007/s00438-012-0724-6. PMC 3881598. PMID 23080263.
- ↑ van Rooyen JM, Abratt VR, Sewell BT (August 2006). "Three-dimensional structure of a type III glutamine synthetase by single-particle reconstruction". J. Mol. Biol. 361 (4): 796—810. doi:10.1016/j.jmb.2006.06.026. hdl:11394/1617. PMID 16879836.
- ↑ 1 2 3 4 5 Garrett, Grisham. Biochemistry. — 6th. — United States of America : Cengage Learning, 2017. — P. 886–889. — ISBN 978-1-305-57720-6.
- ↑ Ivanovsky RN, Khatipov EA (1994). "Evidence of covalent modification of glutamine synthetase in the purple sulfur bacterium". FEMS Microbiology Letters. 122 (1—2): 115—119. doi:10.1111/j.1574-6968.1994.tb07153.x.
- ↑ Krishnan IS, Singhal RK, Dua RD (Apr 1986). "Purification and characterization of glutamine synthetase from Clostridium pasteurianum". Biochemistry. 25 (7): 1589—99. doi:10.1021/bi00355a021. PMID 2871863.
- ↑ Bolay, Paul; Muro-Pastor, M.; Florencio, Francisco; Klähn, Stephan (27 October 2018). "The Distinctive Regulation of Cyanobacterial Glutamine Synthetase". Life. 8 (4): 52. doi:10.3390/life8040052. PMC 6316151. PMID 30373240.
- ↑ Merrick MJ, Edwards RA (December 1995). "Nitrogen control in bacteria". Microbiological Reviews. 59 (4): 604—22. doi:10.1128/MR.59.4.604-622.1995. PMC 239390. PMID 8531888.
- ↑ 1 2 Fisher R, Tuli R, Haselkorn R (June 1981). "A cloned cyanobacterial gene for glutamine synthetase functions in Escherichia coli, but the enzyme is not adenylylated". Proceedings of the National Academy of Sciences of the United States of America. 78 (6): 3393—7. Bibcode:1981PNAS...78.3393F. doi:10.1073/pnas.78.6.3393. PMC 319574. PMID 6115380.
- ↑ Vega-Palas MA, Flores E, Herrero A (July 1992). "NtcA, a global nitrogen regulator from the cyanobacterium Synechococcus that belongs to the Crp family of bacterial regulators". Molecular Microbiology. 6 (13): 1853—9. doi:10.1111/j.1365-2958.1992.tb01357.x. PMID 1630321. S2CID 32757978.
- ↑ Reyes JC, Muro-Pastor MI, Florencio FJ (April 1997). "Transcription of glutamine synthetase genes (glnA and glnN) from the cyanobacterium Synechocystis sp. strain PCC 6803 is differently regulated in response to nitrogen availability". Journal of Bacteriology. 179 (8): 2678—89. doi:10.1128/jb.179.8.2678-2689.1997. PMC 179018. PMID 9098067.
- ↑ García-Domínguez M, Reyes JC, Florencio FJ (June 1999). "Glutamine synthetase inactivation by protein-protein interaction". Proceedings of the National Academy of Sciences of the United States of America. 96 (13): 7161—6. Bibcode:1999PNAS...96.7161G. doi:10.1073/pnas.96.13.7161. PMC 22038. PMID 10377385.
- ↑ García-Domínguez M, Reyes JC, Florencio FJ (March 2000). "NtcA represses transcription of gifA and gifB, genes that encode inhibitors of glutamine synthetase type I from Synechocystis sp. PCC 6803". Molecular Microbiology. 35 (5): 1192—201. doi:10.1046/j.1365-2958.2000.01789.x. PMID 10712699. S2CID 23804565.
- ↑ Klähn S, Schaal C, Georg J, Baumgartner D, Knippen G, Hagemann M, Muro-Pastor AM, Hess WR (November 2015). "The sRNA NsiR4 is involved in nitrogen assimilation control in cyanobacteria by targeting glutamine synthetase inactivating factor IF7". Proceedings of the National Academy of Sciences of the United States of America. 112 (45): E6243-52. Bibcode:2015PNAS..112E6243K. doi:10.1073/pnas.1508412112. PMC 4653137. PMID 26494284.
- ↑ Klähn S, Bolay P, Wright PR, Atilho RM, Brewer KI, Hagemann M, Breaker RR, Hess WR (August 2018). "A glutamine riboswitch is a key element for the regulation of glutamine synthetase in cyanobacteria". Nucleic Acids Research. 46 (19): 10082—10094. doi:10.1093/nar/gky709. PMC 6212724. PMID 30085248.
Обычно почти сразу, изредка в течении часа.
