| Бета-карболин | |
|---|---|
 | |
| Общие | |
| Хим. формула | C11H8N2 |
| Рац. формула | 9H-pyrido[3,4-b]indole |
| Физические свойства | |
| Молярная масса | 168,19462 г/моль |
| Классификация | |
| Рег. номер CAS | 244-63-3 |
| PubChem | 64961 |
| Рег. номер EINECS | 205-959-0 |
| SMILES | |
| InChI | |
| ChEBI | 109895 |
| ChemSpider | 58486 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
β-Карболин (норгарман) — 9H-пиридо[3,4-b]индол. β-Карболиновая структура является основой для ряда алкалоидов, выделенных из растений (гармала и др.), известных под общим названием «β-карболины».
Изомерен α-карболину (1H-пиридо[2,3-b]индолу) и γ-карболину (5H-пиридо[4,3-b]индолу).
История

β-Карболиновые алкалоиды впервые были выделены из растения Peganum harmala, которое традиционно использовалось как эмменагог и абортивное средство на Ближнем Востоке и в Северной Африке. В бассейне Амазонки растения содержащие β-карболины использовались при приготовлении табака и галюциногенных напитков. Экстракт семян Peganum harmala использовалися для лечения рака пищеварительного тракта и малярии в Северо-Западном Китае[1].
Синтез
Общим методом синтеза β-карболинов является реакция Пикте-Шпенглера — взаимодействие замещённых триптаминов с ароматическими и алифатическими альдегидами. В этом синтезе на первой стадии образуются основания Шиффа с последующей электрофильной атакой иминогруппы по типу реакции Манниха по положению 3 индольного ядра с образованием спироиндоленинового промежуточного соединения и его дальнейшей перегруппировки в тетрагидро-β-карболин.

В качестве функционального эквивалента альдегидов могут выступать и α-кетокислоты и их эфиры, в качестве индольного компонента — триптофан и его эфиры; образующиеся в ходе реакции тетрагидрокарболины далее могут быть дегидрированы в β-карболины.
Другим методом синтеза β-карболинового скелета является модификация синтеза изохинолинов по Бишлеру-Напиральскому, в которой вместо N-ацил-β-фенилэтиламинов используются N-ацилтриптамины; этот метод синтеза ведет к 3,4-дигидро-β-карболинам:
Фармакология
Вещества, содержащие β-карболиновую группировку, могут проявлять следующие фармакологические свойства:
- Противомалярийная активность[2].
- Ингибирование моноаминоксидазы, циклинзависимых киназ, топоизомеразы
- Интеркаляция ДНК
- Седативное и анксиолитическое действие
- Гипнотическая активность
- Антиконвульсивная активность
- Притивоопухолевая активность
- Противовирусная, противопаразитарная и противомикробная активность[1]
Структура

Некоторые бета-карболины
В приведённой таблице перечислены наиболее известные бета-карболины и их структурные формулы.
| Short Name | R1 | R6 | R7 | Structure | ||
|---|---|---|---|---|---|---|
| Бета-карболин |  | |||||
| Триптолин |  | |||||
| Пинолин | 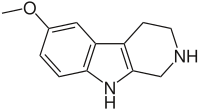 | |||||
| Гарман |  | |||||
| Гармин |  | |||||
| Гармалин |  | |||||
| Тетрагидрогармин | 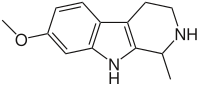 |
Нахождение в природе
β-Карболины содержатся в различных растениях:
- В гармале (лат. Peganum harmala) — многолетнем травянистом растении семейства Парнолистниковых (лат. Zygophyllaceae);
- В ряде представителей порядка Мальпигиецветных (лат. Malpighiáles):
- В южноамериканской лиане Banisteriopsis caapi семейства Мальпигиевых (лат. Malpighiaceae);
- В страстоцветах (пассифлоре, лат. Passiflora);
- В табаке, особенно вида Nicotiana rustica;
а также животных (например, в морских губках[3]).
Литература
- Дуленко В. И., Комиссаров И. В., Долженко А. Т. Бета-карболины. Химия и нейробиология. — Киев: Наукова Думка, 1992 — ISBN 5-12-003118-8
Примечания
- ↑ 1 2 Cao R. et al. β-Carboline Alkaloids: Biochemical and Pharmacological Functions // Curr. Med. Chem. — 2007. — Т. 14, № 4. — С. 479–500. Архивировано 1 февраля 2022 года.
- ↑ Kenny K. H. Ang, Michael J. Holmes, Tatsuo Higa, Mark T. Hamann, and Ursula A. K. Kara. In Vivo Antimalarial Activity of the Beta-Carboline Alkaloid Manzamine A // Antimicrobial Agents and Chemotherapy. — 2000. — Т. 44, № 6. — С. 1645—49. Архивировано 21 октября 2007 года.
- ↑ Karumanchi V. Rao, Marwa S. Donia, Jiangnan Peng, Esther Garcia-Palomero, Diana Alonso, Ana Martinez, Miguel Medina, Scott G. Franzblau, Babu L. Tekwani, Shabana I. Khan, Subagus Wahyuono, Kristine L. Willett, and Mark T. Hamann. Manzamine B and E and Ircinal A Related Alkaloids from an Indonesian Acanthostrongylophora Sponge and Their Activity against Infectious, Tropical Parasitic, and Alzheimer's Diseases // J. Nat. Prod.. — 2006. — Т. 69, № 7. — С. 1034-40.
Ссылки
- [www.erowid.org/library/books_online/tihkal/tihkal44.shtml TiHKAL #44]
- [www.erowid.org/library/books_online/tihkal TiHKAL] in general
- Beta-carbolines in Coffee
- Antidepressant-like effect of harmane and other beta-carbolines in the mouse forced swim test
Обычно почти сразу, изредка в течении часа.

