| Бактериородопсин | |
|---|---|
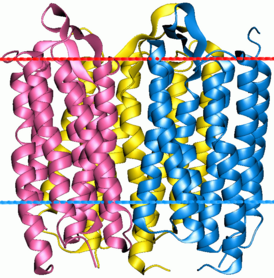 Тример бактериородопсина | |
| Идентификаторы | |
| Символ | Bac_rhodopsin |
| Pfam | PF01036 |
| InterPro | IPR001425 |
| PROSITE | PDOC00291 |
| SCOP | 2brd |
| SUPERFAMILY | 2brd |
| TCDB | 3.E.1 |
| OPM superfamily | 6 |
| OPM protein | 1vgo |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Бактериородопси́ны — семейство мембранных светочувствительных белков археот (например, галобактерий). Бактериородопсины осуществляют перенос протона через плазматическую мембрану, по строению сходны с родопсинами млекопитающих.
Этот белок выполняет ту же функцию, что и хлорофилл в других организмах - обеспечивает преобразование энергии солнечного света в энергию химических связей. Он действует как зависимая от света протонная помпа. Поглощение кванта света приводит к быстрым структурным изменениям в молекуле, благодаря которым происходит перенос катиона водорода с цитоплазмы на внешнюю сторону клеточной мембраны.
Состав белка
Трансмембранная часть бактериородопсина сложена из 7 регулярных -спиралей, идущих от одного до другого края мембраны, а одинокая -шпилька и все нерегулярные участки цепи (соединяющие спирали-петли) выходят из мембраны[1]. Сидящие на -спиралях гидрофобные группы обращены «наружу» к липидам (тоже гидрофобным) мембраны. Полярные же группы (их немного) обращены внутрь очень узкого канала, по которому идет протон.
Процесс переноса протона через мембрану
Протонная проводимость осуществляется при содействии прикреплённой внутри пучка спиралей молекулы кофактора — ретиналя. Он перекрывает центральный канал бактериородопсина. Поглотив фотон, ретиналь переходит из полностью-транс- в 13-цис-форму. При этом он изгибается и переносит протон с одного конца семиспирального пучка на другой. А потом ретиналь разгибается и возвращается назад, но уже без протона.
Применение бактериородопсина в нано-биотехнологиях
В 1971 году Остерхельт (ФРГ) и Стохениус (США) сумели выделить бактериородопсин из клеточной мембраны галобактерии Halobacterium halobium[2][3]. Природные фотопреобразующие наноматериалы используются в фармакологии, биомедицине, био- и нанотехнологиях. В 1994-м группа российских ученых впервые в мире получила пластинки с бактериородопсином. Пластинки с бактериородопсином можно применять в биомолекулярной электронике. Главный результат достижения — ориентирование пурпурных мембран, которые содержат бактериородопсин в гидрофобных и гидрофильных средах[4]. В пластинках на желатиновой основе содержится около 50 % бактериородопсина. На основе бактериородопсина создается фоторецептор с микроэлектродом из SnO2 и на светоизлучающие диоды подается сигнал.[5] Главное применение этого нанотехнологического материала — в искусственных энерго- и фотопреобразующих мембранах и нанопленках.
Галерея
 |
 |
 |
Примечания
- ↑ А. В. Финкельштейн, О. Б. Птицын, «Физика белка», 2002
- ↑ Oesterhelt D., Stoeckenius W. (1971) Rhodopsin — Like Protein from the Purple Membrane of Halobacterium Halobium, Nature, V. 233, № 89, pp. 149-60.
- ↑ Vought B.W., Birge R.R. (eds.) (1999) Molecular electronics and hybrid computers./in: Wiley Encyclopedia of Electrical and Electronics Engineering, Wiley-Interscience: New York,.pp. 477—490.
- ↑ Мосин О. В., Складнев Д. А., Егорова Т. А., Швец В. И. Получение бактериородопсина H. halobium, меченного дейтерием по остаткам ароматическим аминокислот фенилаланина, тирозина и триптофана // Биотехнология, 1996. — № 10. — С. 24-40.
- ↑ Мосин O.В., Складнев Д. А., Швец В. И. Включение дейтерированных ароматических аминокислот в молекулу бактериородопсина Halobacterium halobium // Прикладная биохимия и микробиология, 1999. — Т. 35. — № 1. — с. 34-42.
- ↑ Nishikawa, T.; Murakami, M. Crystal structure of the 13-cis isomer of bacteriorhodopsin. RCSB Protein Data Bank (PDB) (28 марта 2005). doi:10.2210/pdb1x0s/pdb. Дата обращения: 7 октября 2012. Архивировано 15 октября 2013 года.
- ↑ Nishikawa, T.; Murakami, M. Crystal structure of the 13-cis isomer of bacteriorhodopsin in the dark-adapted state. (англ.) // J.Mol.Biol. : journal. — Elsevier, 2005. — Vol. 352. — P. 319—328. — doi:10.1016/j.jmb.2005.07.021. — PMID 16084526.
- ↑ Image created with RasTop Архивная копия от 17 апреля 2015 на Wayback Machine (Molecular Visualization Software)
См. также
Обычно почти сразу, изредка в течении часа.



