| Triyoduro de nitrógeno | ||
|---|---|---|
 Fórmula estructural | ||
 Estructura tridimensional. | ||
| General | ||
| Otros nombres | Yoduro de nitrógeno, Triyoduro de amoníaco | |
| Fórmula estructural |
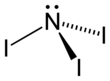 | |
| Fórmula molecular | NI3 | |
| Identificadores | ||
| Número CAS | 13444-85-4[1] | |
| ChemSpider | 55511 | |
| PubChem | 61603 | |
| Propiedades físicas | ||
| Apariencia | rojo (parecido al ladrillo) | |
| Masa molar | 39 477 g/mol | |
| Propiedades químicas | ||
| Solubilidad en agua | no | |
| Peligrosidad | ||
| NFPA 704 |
0
1
4
| |
| Riesgos | ||
| Riesgos principales | Explosivo extremadamente sensible | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El triyoduro de nitrógeno o triioduro de nitrógeno es un compuesto inorgánico con la fórmula NI3. Se trata de un explosivo extremadamente sensible; pequeñas cantidades explotan cuando son tocadas ligeramente (incluso usando una pluma), liberando una nube irritante púrpura de vapor de yodo, incluso puede ser detonado por la radiación alfa. El NI3 posee una compleja química estructural que es difícil de estudiar debido a la inestabilidad de los derivados. Su punto de fusión empieza a los -20 °C y este empieza a sublimar.
YouTube Encyclopedic
-
1/3Views:1 552 1359 3792 457 079
-
Cápsula de fuego instantáneo - Exp Supervivencia (Experimentos Caseros)
-
Ejercicio equilibrio químico 14: equilibrio yodo + yoduro = triyoduro (selectividad Com. Valenciana)
-
Cómo hacer hielo seco (Experimentos Caseros)
Transcription
Hola, muy buenas a todos, bienvenidos al canal de Experimentos Caseros. Hoy vamos a hacer cápsulas de fuego instantáneo. Necesitamos: Glicerina, que venden en farmacias Permanganato, que suelen vender en las farmacias en forma de pastillas, aunque nosotros lo tenemos ya en polvo Y por último, cápsulas, como pueden ser las de vitaminas o suplementos alimenticios. Primero vamos a ver la reacción que tiene el permanganato de potasio con la glicerina. Pero antes de nada, es muy importante utilizar gafas protectoras y unos guantes para protegernos las manos. ¡Y mucha agua! Primero, vamos a echar un poquito de permanganato de potasio Y luego una gota de glicerina ¡Y esperamos! Es muy importante que uséis una base que soporte muy bien el calor. Nosotros, por ejemplo, hemos usado una de aluminio, ya que la reacción alcanza una gran temperatura. Vosotros podéis usar también una maceta de barro o lo que tengáis por casa. También es esencial hacerlo en exteriores, ya que produce mucho humo Cuando echéis la glicerina tened paciencia porque la reacción tarda un minuto y medio o un minuto más o menos. ¡Así que no se os ocurra acercar la cabeza! Ya hemos comprobado su eficacia, ahora vamos a preparar las cápsulas para poder sobrevivir en el campo. Y para ello lo primero que tenemos que hacer es separar las dos partes de la cápsula, vaciar su interior Y a continuación llenamos una de ellas con glicerina, la volvemos a cerrar Y usando siempre protección, vamos a llenar la otra cápsula con el permanganato. Y la cerramos Ahora que ya tenemos cada una de nuestras cápsulas preparadas, vamos a comprobar su eficacia. Primero tenemos que echar el permanganato y luego una gota de glicerina Y esperamos El permanganato de potasio es una fuente concentrada de oxígeno, mientras que la glicerina es un tipo de alcohol. Al mezclarse, se produce una reacción exotérmica que libera muchísimo calor. Y es por eso que al llevarlas separadas no hay ningún tipo de peligro, pero cuando lleguemos al campo y las mezclemos, ya tenemos nuestro fuego, ¡sin necesidad de llama! Bueno, esperamos que os haya gustado Y si queréis que hagamos más trucos de supervivencia como estos, decídnoslo abajo en los comentarios Y ya sabéis, dadle a like, favoritos, seguidnos en Facebook y Twitter que están abajo en la descripción y comparte Y nos vemos en el próximo vídeo, ¡hasta la próxima!
Estructura del NI3 y sus derivados
El triyoduro de nitrógeno fue caracterizado por primera vez mediante cristalografía de rayos X en 1990 cuando este fue preparado sin utilizar amoníaco. El nitruro de boro reacciona con monofluoruro de yodo en triclorofluorometano a -30 °C para producir NI3 puro con un rendimiento bajo:
- BN + 3IF → NI3 + BF3
El NI3 es piramidal (C3v simetría molecular), como son los otros trihaluros de nitrógeno y amoníaco.[2]
El material generalmente denominado "triyoduro de nitrógeno" se prepara mediante la reacción de yodo con amoníaco. Cuando esta reacción se lleva a cabo a bajas temperaturas en amoníaco anhidro; el producto inicial es NI3 · (NH3)5, pero este material pierde un poco de amoníaco con el calentamiento para dar el aducto 1:1 NI3 · (NH3). Este aducto fue descrito por primera vez por Bernard Courtois en 1812, y su fórmula se determinó finalmente en 1905 por Oswald Silberrad.[3] Esta estructura de estado sólido consiste en cadenas de -NI2-I-NI2-I-NI2-I-... Moléculas de amoniaco se encuentran entre las cadenas. En la oscuridad, manteniéndose frío y humedecido con amoníaco, NI3 · (NH3) es más estable. Cuando el NI3 está seco se convierte en un explosivo altamente sensible y muy inestable que puede ser detonado incluso usando una pluma, esto se debe a que la estabilización obtenida por el aducto con el NH3 es muy baja y una perturbación energética baja puede romper esta estabilidad, dando paso a la descomposición instantánea a NH3, I2 y N2 todos en estado gaseoso. Se puede observar que pasa de un estado sólido a tres gases, lo cual muestra el por qué la reacción libera tanta energía en tan poco tiempo con una energía de activación muy baja.
Descomposición
La descomposición del NI3 se produce mediante la siguiente reacción:
- 2 NI3(s) → N2(g) + 3 I2(g) ΔH = –290 kJ/mol
Véase también
Enlaces externos
Referencias
- ↑ Número CAS
- ↑ Holleman, A. F.; Wiberg, E. (2001). Academic Press, ed. Inorganic Chemistry. San Diego. ISBN 0-12-352651-5.
- ↑ Silberrad, O. (1905). «The Constitution of Nitrogen Triiodide». Journal of the Chemical Society, Transactions 87: 55-66. doi:10.1039/CT9058700055.

