| Psilocibina | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
| [3-(2-dimetilaminoetil)-1H-indol-4-il] dihidrógeno fosfato | ||
| Identificadores | ||
| Número CAS | 520-52-5 | |
| Código ATC | No adjudicado | |
| PubChem | 10624 | |
| DrugBank | 11664 | |
| ChemSpider | 10178 | |
| KEGG | C07576 | |
| ChEBI | 8614 | |
| Datos químicos | ||
| Fórmula | C12H17N2O4P | |
| Peso mol. | 284.25 g/mol | |
| Datos físicos | ||
| Densidad | 1.41 g/cm³ | |
| P. de fusión | 220—228 °C | |
| P. de ebullición | 523.44 °C (974 °F) | |
| Farmacocinética | ||
| Excreción | renal | |
| Datos clínicos | ||
| Vías de adm. | oral | |
La psilocibina (también conocida como 4-PO-DMT o 4-fosforiloxi-N,N-dimetiltriptamina) es un alcaloide triptamínico que en el cuerpo se metaboliza en psilocina, un compuesto psicodélico responsable del efecto psicoactivo de ciertos hongos comestibles.
Algunos hongos que poseen psilocibina son usados recreacionalmente y como elemento enteógeno en rituales de la medicina tradicional americana. En un artículo de la revista Life de 1957, el banquero estadounidense R. Gordon Wasson describió sus experiencias por la ingestión de hongos que contenían psilocibina durante una ceremonia tradicional en México, introduciendo la medicina dentro de la cultura popular en los Estados Unidos. Poco tiempo después, el químico suizo Albert Hofmann purificó el principio activo de la psilocibina desde el hongo Psilocybe mexicana y desarrolló un método sintético para producir la droga.
La psilocibina es producida naturalmente por alrededor de 200 especies de hongos, incluyendo los del género Psilocybe como P. cubensis, P. semilanceata y P. cyanescens, y además ha sido publicado que se ha logrado aislar desde una docena de géneros. Se los conoce colectivamente como hongos psilocibios. La posesión, y en algunos casos el uso de la psilocibina o la psilocina, es ilegal en muchos países alrededor del mundo.[1]
Aquellos que proponen su uso la consideran como un enteógeno y como una herramienta para complementar distintas prácticas de trascendencia como la meditación, psiconáutica y la psicoterapia psicodélica. La intensidad y duración del efecto enteogénico de los hongos psilocibios es altamente variable, dependiendo esta de las especies de hongos, la dosis, características fisiológicas individuales y del set and setting. Una vez ingerida, la psilocibina es rápidamente metabolizada a psilocina, la cual actúa como un agonista parcial en los receptores de serotonina 5-HT2A y 5-HT1A en el cerebro. Los efectos de la psilocibina duran normalmente desde 3-8 horas; sin embargo, para los individuos que la consumen el efecto parece mucho más largo debido a la distorsión producida en la percepción del tiempo. La psilocibina posee una baja toxicidad y no ha sido documentada una dosis letal debida a la ingestión de esta substancia.
YouTube Encyclopedic
-
1/5Views:5 6951 65642313 0164 379
-
David Serrano_La psilocibina, su uso en psicoterapia e investigaciones autorizadas_22/03/2014
-
Depresión, ansiedad y psilocibina
-
Ciência Psicadélica - Psilocibina
-
Psilocibina no Fantástico
-
La psilocibina - Viaggio attraverso la coscienza
Transcription
Historia

El banquero estadounidense y micólogo aficionado R. Gordon Wasson y su esposa Valentina estudiaron las prácticas religiosas antiguas de los pueblos indígenas en México entre los cuales, algunos de ellos ingerían hongos. En 1957 publicaron un artículo en la revista Life titulado "Buscando el hongo mágico" (Seeking the Magic Mushroom), en el cual describían las experiencias alucinatorias durante aquellos rituales.[2] Luego fueron acompañados en otra expedición por el micólogo francés Roger Heim, director del Museo Nacional de Historia Natural de Francia, durante esta expedición se hizo posible la identificación de varios hongos como especies de Psilocybe.[3] A su vez, Heim también logró cultivar el hongo en Francia, y envió algunas muestras para analizar al químico Albert Hofmann, que se encontraba trabajando para la farmacéutica multinacional suiza Sandoz. Hofmann, que había sintetizado el LSD en 1938 fue el primero en reconocer la importancia y la estructura química de los compuestos puros que llamó psilocibina y psilocina. Encabezando un grupo de investigación que fue capaz de identificar y aislar los compuestos desde Psilocybe mexicana,[4] Hofmann fue ayudado por su predisposición a ingerir extractos de hongos.[5] Él y sus colegas sintetizaron luego una cierta cantidad de compuestos químicamente similares a la psilocibina natural:
Estas son esencialmente las mismas moléculas excepto por: (1) el grupo fosforilo o hidroxi en la parte superior del anillo de indol fue movido hacia otras posiciones en el anillo, y (2) se agregaron diferentes cantidades de grupos metilo (CH3) y otras cadenas carbonadas a las cadenas laterales y al nitrógeno en el anillo indólico para ver cómo estos cambios podían afectar la psicoactividad.[6]
Dos análogos dietilo (dos grupos etilo en lugar de los dos grupos metilo) de la psilocibina y la psilocina fueron sintetizados por Hofmann, 4-fosforiloxi-N,N-dietiltriptamina, llamado CY-19 y 4-hidroxi-N,N-dietiltriptamina, llamado CZ-74. Debido a que sus efectos duraban aproximadamente unas tres horas y media (comparado a casi el doble de tiempo provocado por la psilocibina), probaron ser más provechosas en las clínicas europeas que practicaban el método psicoterapéutico de "terapia psicolítica" junto al uso controlado de drogas psicodélicas.[6] Sandoz comercializó y vendió psilocibina pura bajo el nombre de Indocibina a médicos alrededor del mundo.[7]
A principios de los años '60, la Universidad de Harvard se convirtió en terreno de estudio de la psilocibina, a través de los esfuerzos de Timothy Leary y su asociado Richard Alpert (ahora conocido como Ram Dass). Leary fue capaz de obtener psilocibina sintética de Hofmann a través de la farmacéutica Sandoz (ahora Novartis). Aunque una cantidad considerable de experimentos a principios de los '60 demostraron resultados positivos del uso de la psilocibina en la psiquiatría clínica, la histeria del LSD de aquellos tiempos arrastraron a la psilocibina con ella dentro de la categoría de Planificación I de las drogas ilícitas en 1970. Los años '70 vieron el surgir de la psilocibina como el "enteógeno de preferencia".[8] Esto se debió, en parte, a una amplia difusión de información acerca de esta, que incluyó también en el primer libro de Carlos Castaneda y en varios libros de otros autores que enseñaban la técnica para que uno mismo cultivara sus propios hongos psilocibios. Uno de los más populares de aquellos libros fue editado bajo los seudónimos de O.T. Oss y O.N. Oeric por J. Bigwood, D.J. McKenna, K. Harrison McKenna y T.K. McKenna, titulado "Psilocibina: La guía del cultivador del hongo mágico" (Psilocybin: Magic Mushroom Grower's Guide. Se vendieron cerca de 100 000 copias por 1981:[9]
Estos autores adaptaron la técnica de San Antonio (para la producción de hongos comestibles mediante la incubación de cultivos miceliales en un sustrato de centeno; San Antonio 1971) a la producción de Psilocybe [Stropharia] cubensis. La nueva técnica requiere del uso de implementos comunes de cocina, y por primera vez, personas que no son profesionales son capaces de producir un potente enteógeno en su propia casa, sin el acceso a tecnología sofisticada, equipamiento o suministros químicos.[10]
Biología

La psilocibina es un compuesto natural que se encuentra en concentraciones variables en alrededor de 200 especies de hongos basidiomicetos, principalmente entre los siguientes géneros: Psilocybe (116 especies), Gymnopilus (14), Panaeolus (13), Copelandia (12), Hypholoma (6), Pluteus (6) Inocybe (6), Conocybe (4), Panaeolina (4), Gerronema (2) y Agrocybe, Galerina y Mycena (1 especie cada una).[11] Las esporas de estos hongos no contienen psilocibina o psilocina. El sombrero del hongo tiende a poseer mayor cantidad de los compuestos psicoactivos que el tallo del mismo.[12][13][14] La potencia total varía de forma importante entre especies y aún entre individuos de la misma especie en el mismo sustrato.[15] Los hongos más jóvenes y pequeños poseen una concentración más alta de alcaloides y poseen un sabor más suave que aquellos más grandes y maduros.
En general, el contenido de psilocibina en los hongos es muy variable (desde casi nada hasta aproximadamente un 1,5 % del peso seco del hongo)[16] y depende de las especies, del crecimiento y de las condiciones de secado como también del tamaño del hongo.[17] El micelio maduro contiene algo de psilocibina, mientras que el micelio joven (recientemente germinado de las esporas) no contiene cantidades apreciables de alcaloides.[18] Muchas especies de hongos que contienen psilocibina tienen también pequeñas cantidades de los análogos de la psilocibina: baeocistina y norbaeocistina.[19][20][21] La mayoría de las especies de los hongos que contienen psilocibina adquieren manchas (escraches) azuladas cuando son manipuladas o dañadas[22] debidas a la oxidación de los compuestos fenólicos. Esta reacción, sin embargo, no es un método definitivo utilizado para la identificación o determinación de la potencia de un hongo.[15][23]
Química
La psilocibina es un profármaco que es convertido farmacológicamente en el compuesto activo psilocina dentro del cuerpo mediante una reacción de desfosforilación.[24] Esta reacción química tiene lugar bajo condiciones fuertemente ácidas, o también, bajo las condiciones fisiológicas del cuerpo donde interviene una enzima denominada fosfatasa. La oxidación de la psilocina por parte de la enzima hidrox-indol oxidasa[25] da el compuesto azul oscuro <i>orto</i>-quinona.[26] Este último experimenta rápidamente una transferencia electrónica, una característica que se piensa que juega un importante papel en su actividad fisiológica.[27][28]
La psilocibina es una triptamina que posee una estructura química derivada del triptófano que posee una configuración de tipo indol unida a un sustituyente etilamina. Posee una estrecha semejanza estructural con el neurotransmisor serotonina (5-hidroxitriptamina). La psilocibina es un alcaloide zwiterriónico que es soluble en agua, moderadamente soluble en metanol y etanol e insoluble en la mayoría de los disolventes orgánicos. La exposición a la luz es perjudicial para la estabilidad de las disoluciones acuosas de psilocibina oxidándose rápidamente (consideración que se debe tener en cuenta cuando es utilizada como una solución estándar analítica).[29] Un método para la producción a gran escala de psilocibina sin la necesidad de una purificación cromatográfica fue descripta por un grupo japonés en el año 2003. El método, que comienza con 4-hidroxi-indol genera psilocibina a partir de la psilocina con un rendimiento del 85 %,[30] un marcado incremento sobre los rendimientos de las síntesis previamente publicadas.[31][32][33] La psilocibina purificada es un polvo blanco en forma de agujas con un punto de fusión entre los 190 °C-198 °C.[30]
Métodos analíticos

Muchas técnicas analíticas son usadas para identificar y medir la cantidad de psilocibina en los hongos. Algunas de estas técnicas son: cromatografía en capa fina,[34] cromatografía gaseosa acoplada a la espectrometría de masas (GC-MS),[35] espectroscopia de movilidad iónica,[14] electroforesis capilar,[36]espectroscopia ultravioleta-visible,[37] espectroscopia infrarroja,[38] Cromatografía líquida de alta eficacia (HPLC) con métodos de detección ultravioleta,[29] por fluorescencia,[39] electroquímica,[40] o mediante la utilización de un electrospray en la espectrometría de masas.[41] Las primeras técnicas utilizaban la cromatografía de gases, sin embargo, el problema era que con este método la psilocibina se defosforilaba a psilocina antes de realizar el análisis complicando al mismo.[42][43]
Se han desarrollado varios métodos cromatográficos para detectar la psilocina en los fluidos corporales: el sistema rápido de emergencia de identificación de drogas (REMEDi HS)(Rapid Emergency Drug identification System) es un método de cribado de drogas basado en la HPLC;[44] HPLC con detección electroquímica;[40][45] GC-MS;[44][46] y cromatografía líquida acoplada con la espectrometría de masas.[47] A pesar de que la determinación de los niveles de psilocina en orina pueden ser realizados sin la purificación de la muestra, los análisis del plasma o el suero requiere una extracción previa seguida de una derivación de los extractos en el caso de la GC-MS. También se ha desarrollado un inmunoensayo específico para la detección de la psilocina en muestras de sangre entera.[48] Una publicación durante el año 2009 describió la separación de drogas ilícitas de importancia forense (como la psilobicina y psilocina) utilizando HPLC a alta velocidad (se hacían identificables dentro de los 0,5 min de análisis).[49]
Farmacología
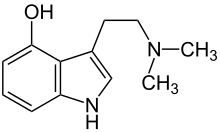
La psilobicina se defosforila a psilocina la cual actúa como un agonista parcial de varios receptores de serotonina. La psilocina posee una alta afinidad por el receptor de serotonina 5-HT2A en el cerebro donde imita los efectos de la serotonina, La psilocina se une con menor afinidad a otros receptores serotoninérgicos como 5-HT1A 5-HT1D y 5-HT2C.[50] Estos receptores serotoninérgicos interactúan con las neuronas piramidales en la corteza cerebral, las cuales se cree que están involucradas en la percepción del dolor y la ansiedad.[51] Los efectos psicomiméticos de la psilocina pueden ser bloqueados mediante la administración de drogas como ketansarina y risperidona que son antagonistas del receptor 5-HT2A.[52] Los análogos estructurales de la psilocibina y de la psilocina son utilizados para la determinación estructural y funcional del receptor acoplado a proteínas G 5-HT2C.[53][54] A diferencia del LSD, la psilocibina o la psilocina no poseen afinidad por el receptor D<sub>2</sub> de dopamina.[50]
Medicina
La psilocibina ha sido investigada como un tratamiento experimental para muchas enfermedades.[55] En 1961, Timothy Leary y Richard Alpert llevaron a cabo el Proyecto Psilocibina de Harvard, ejecutando una cantidad de experimentos respecto al uso de la psilocibina en el tratamiento de trastornos de la personalidad y otros usos en tratamientos psicológicos.[56]
Un estudio piloto conducido por Francisco Moreno en la Universidad de Arizona y financiado por la Asociación Multidisciplinaria para los Estudios Psicodélicos examinó los efectos de la psilocibina en nueve pacientes con trastorno obsesivo-compulsivo (TOC).[57] El mismo halló que la psilocibina puede ser administrada de forma segura a pacientes con TOC resultando en una reducción sustancial de los síntomas del mismo en muchos de los pacientes.[58]
El tratamiento de depresión mediante la psicoterapia asistida por psilocibina está siendo examinado.[59][60][61] En 2018 la Food and Drug Administration (FDA) designó como Breakthrough Therapy (Terapia innovadora) a esta terapia con psilocibina para depresiones resistentes a los tratamientos y en 2019 para trastorno depresivo mayor.[62][63]
Otros dos estudios investigan la posibilidad de que la psilocibina pueda alivianar el sufrimiento psicológico asociado al cáncer. Un estudio, conducido por Charles Grob, involucra 12 personas con cáncer terminal a las cuales se les administra el alucinógeno o el placebo en dos sesiones separadas.[64] El segundo estudio, conducido por Roland Griffiths, administra psilocibina a gente que «con un diagnóstico actual o pasado de cáncer la cual posee algo de ansiedad o se sienten deprimidos acerca de su condición».[65] Los resultados preliminares indican que dosis bajas de psilocibina pueden mejorar el humor y reducir la ansiedad de los pacientes en etapas avanzadas de la enfermedad, y esos efectos, duran de dos semanas a seis meses.[66] En el año 2008, un equipo de investigación de la Escuela de Medicina Johns Hopkins publicó lineamientos para el manejo responsable de ensayos médicos con psilocibina y otros alucinógenos en humanos.[67]
Además, la psilocibina se ha mostrado prometedora a la hora de alivianar el dolor causado por las cefaleas en racimos, a veces considerada no solo como la más dolorosa de las cefaleas,[68] sino como «uno de los peores dolores provocados por síndromes conocidos por la humanidad».[69] En un estudio de 2006, 22 de 26 pacientes con cefalea en racimos reportaron éxito a la hora de prevenir ataques mediante el uso de psilocibina, y 18 de 19 consumidores de psilocibina dijeron tener períodos más largos de tiempo sin sufrir ataques.[70]
La psilocibina tiene, según un estudio publicado en el Journal of the American Medical Association Psychiatry, la capacidad de detener el consumo excesivo de alcohol.[71]
Toxicidad

La toxicidad de la psilocibina es baja; en ratas la dosis letal media (DL50) es de 280 mg/kg, aproximadamente, una vez y media más que la misma de la cafeína. Cuando es administrada mediante la vía intravenosa en conejos, la DL50 de la psilocibina es aproximadamente de 12,5 mg/kg[72] (los conejos sin embargo, son extremadamente intolerantes a los efectos de la mayoría de los efectos de las drogas psicoactivas[cita requerida]). La dosis mortal de la psilocibina sola es desconocida en el caso de niveles recreativos o medicinales y jamás se ha documentado la misma; un caso reportado en 2008 decía «la muerte debida a la ingestión de psilocibina sola es desconocida para niveles recreacionales o medicinales».[73] La psilocibina como mucho corresponde al 1 % del peso total de hongos de Psilocybe cubensis, y se necesitarían aproximadamente 1,7 kilogramos de hongos secos o 17 kilogramos de hongos frescos para que una persona de 60 kg alcance la DL50 de 280 mg/kg medida para las ratas.
Fisiología
La psilocibina es absorbida a través de la boca y el estómago. Los efectos comienzan de 10-40 minutos luego de la ingestión de los hongos que contienen la psilocibina y dura de 2-6 horas dependiendo de la dosis, la especie del hongo y el metabolismo del individuo. Una dosis recreativa típica es de 10–50 mg de psilocibina. Sin embargo, una muy pequeña cantidad de personas son inusualmente sensibles a los efectos de la psilocibina, donde una dosis umbral de alrededor de 2 mg de psilocibina resulta en efectos normalmente asociados a dosis medianas a altas. De la misma manera, existen personas que requieren dosis relativamente altas para alcanzar los efectos normales de una dosis pequeña. La química cerebral y el metabolismo del individuo juegan un papel principal en la respuesta del individuo a la psilocibina.[74]
La mayor parte de la psilocibina es metabolizada en el hígado donde se convierte en psilocina, la cual es degradada por la enzima monoamino oxidasa para producir diversos metabolitos en el plasma sanguíneo incluyendo 4-hidroxiindol-3-acetaldehído, 4-hidroxitriptopol y 4-hidroxiindol-3-acetato.[50] A veces la psilocibina no es degradada enzimáticamente y en su lugar forma un glucurónido—un método bioquímico utilizado por animales para eliminar las sustancias tóxicas mediante la unión con un ácido glucurónico, el cual es excretado a través de la orina.[46] Las concentraciones de psilocina en el plasma de voluntarios adultos promedian alrededor de 8 µg/L dentro de las 2 horas siguientes a la ingestión de una dosis oral única de 15 mg de psilocibina;[75] los efectos psicológicos suceden con una concentración plasmática de 4–6 µg/L.[50]
La tolerancia física y mental a la psilocibina se produce y se disipa rápidamente. La ingestión de psilocibina más de tres o cuatro veces en una semana (especialmente en días consecutivos) puede disminuir sus efectos. La tolerancia se elimina luego de pocos días, los usuarios frecuentes intercalan las dosis en espacios de cinco a siete días para evitar este efecto de tolerancia. Los estudios demostraron que puede desarrollarse una tolerancia cruzada entre la psilocibina y el compuesto farmacológicamente similar LSD.[76][77] Los inhibidores de la monoaminooxidasa (IMAO) sostienen los efectos de la psilocibina por más tiempo; por lo tanto, las personas que toman IMAO debido a un problema médico pueden experimentar efectos altamente potenciados.[78]
El uso repetido de la psilocibina no lleva a una dependencia física a la droga.[50] Un estudio del año 2008 concluyó que, basándose en información de Estados Unidos para el período 2000-2002, en un grupo de adolescentes (definidos entre 11-17 años de edad) el uso de drogas alucinógenas (incluyendo la psilocibina) no incrementa el riesgo de drogodependencia en la adultez; en contraste al uso durante la adolescencia de cannabis, cocaína, inhalantes, medicinas ansiolíticas y estimulantes, los cuales todos están asociados con «un riesgo aumentado de desarrollar rasgos clínicos asociados a la drogodependencia».[79]
Efectos

Los efectos de la psilocibina son muy variables y dependen de la mentalidad y escenario en el cual el consumidor se encuentra al momento de experimentar tales efectos. Esto se denomina comúnmente set and setting.
A principios de los años '60, Leary y sus colegas en la Universidad de Harvard emprendieron experimentos para comprender el papel del set and setting sobre los efectos de la psilocibina. Administraron la droga a 175 personas de distintas procedencias sociales en un ambiente cálido y confortable libre de distracciones; con el objeto de hacerlo similar a una tranquila sala de estar. A 98 de esas personas se les dio cuestionarios para evaluar sus experiencias y la contribución de los factores sociales y circunstanciales. Aquellos individuos que ya habían tomado psilocibina describieron experiencias más placenteras que aquellos que no lo habían hecho. El tamaño del grupo, la dosis, la preparación y las expectativas fueron importantes determinantes de la respuesta a la droga. Los grupos grandes (de ocho o más individuos) fueron descriptos en forma negativa como menos alentadores por los integrantes y sus experiencias fueron menos placenteras. Inversamente, los grupos más pequeños (menos de seis) fueron vistos de forma más comprensiva y aquellos que lo integraban mostraron experimentar reacciones positivas a la droga. Los investigadores propusieron que la psilocibina probablemente provoque un aumento de la sugestibilidad, haciendo al individuo más receptivo a las interacciones interpersonales o a los estímulos medioambientales.[80] Estas conclusiones fueron corroboradas en un estudio posterior por Berge (1999), quien concluyó que: la dosis y el set and setting son factores fundamentales y definitivos en experimentos que probaron los efectos de drogas psicodélicas en la creatividad de los artistas.[81]
Luego del consumo de psilocibina, la persona puede inicialmente sentirse algo desorientada, letárgica y eufórica o a veces deprimida. Con dosis bajas, los efectos alucinatorios pueden ocurrir, como la percepción más intensa de los colores o la animación de las formas geométricas. La alucinación con ojos cerrados puede experimentarse, donde el individuo puede ver formas geométricas multi-coloreadas y vívidas secuencias imaginarias. A dosis más altas, los efectos alucinatorios aumentan y las experiencias tienden a ser menos sociales y más introspectivas o enteogénicas. Las alucinaciones con ojos abiertos son más comunes y pueden ser muy detalladas aunque raramente pueden ser confundidas con la realidad.[82] Basándose en un estudio de 27 ingresos hospitalarios de pacientes (con edades que iban de los 12-24 años) que habían consumido Psilocybe semilanceata, un reporte clínico de 1980 resumió la distribución de los síntomas clínicos provocados por la sobredosis de psilocibina como los siguientes: trastorno de la percepción (23 pacientes), midriasis (dilatación de las pupilas) (20), disforia (13), hiperreflexia (12), taquicardia (10), aletargamiento (7) y euforia (5).[83] Estas respuestas clínicas son similares a los resultados obtenidos en varios de los primeros estudios donde se les administraba psilocibina pura a voluntarios humanos.[84]
Modulaciones de la percepción
La modulación en la percepción del tiempo en los estados inducidos por la psilocibina han sido reportados subjetivamente,[85] y medidos objetivamente.[86] En tales estudios, la psilocibina redujo significativamente en los sujetos la reproducción de intervalos de tiempo más largos de 2 segundos, afectando su capacidad para sincronizar con intervalos mayores a dos segundos. Estudios recientes acerca de los efectos de la psilocibina sobre la reproducción de intervalos de tiempo pueden arrojar luz sobre las alteraciones cualitativas de la percepción del tiempo en estados alterados de la conciencia inducidos experimentalmente, estados místicos y en la psicopatología.[87]
Esta modulación de la percepción de tiempo hace que los sujetos perciban el momento presente como la eternidad que, en ocasiones, da al consumidor una sensación de incertidumbre, ansiedad, incomodidad y/o impaciencia.
Factores que pueden causar una experiencia negativa
El término "mal viaje" describe una reacción acompañada con diversos grados de ansiedad, sentimientos poco placenteros o a veces un comportamiento no-razonable. El término se aplica generalmente cuando se describe una reacción que se caracteriza principalmente por un pánico u otras sensaciones desagradables como la parte más memorable de la experiencia psicodélica.
La psilocibina abre la mente para experiencias amplias y deja el individuo más susceptibles a la energía externa. Ambiente social tenso y negativos pueden servir de un factor que provoque la sensación de pánico; para evitar la experiencia negativa, uno debe estar listo mentalmente y preparar un ambiente confortable y seguro, sin ruidos excesivos o fuentes de tensión.
Experiencias místicas
La psilocibina puede inducir experiencias místicas de significancia personal y espiritual. Por ejemplo, en el Experimento de Marsh Chapel, dirigido por el estudiante graduado Walter Pahnke en la Harvard Divinity School bajo la supervisión de Timothy Leary.[88] Casi todos los estudiantes graduados del seminario que recibieron psilocibina dijeron haber tenido experiencias profundamente espirituales.[89] Luego de pasados 25 años del experimento, todos aquellos sujetos a los cuales se les administró la psilocibina en el mismo describieron su experiencia como de una «genuina naturaleza mística y la caracterizaron como uno de los momentos más altos de su vida espiritual».[90] Sin embargo, Rick Doblin consideró al estudio original parcialmente defectuoso debido a una implementación incorrecta del método del doble ciego. Además de varias preguntas imprecisas en el cuestionario. Sostiene que este estudio sugiere "una duda considerable acerca de la afirmación de que las experiencias místicas catalizadas por drogas no son de ninguna manera inferiores a las experiencias místicas sin drogas tanto en su contenido inmediato como en sus efectos a largo plazo".[91]
En el año 2006, un grupo de investigadores de la Escuela de Medicina Johns Hopkins conducidos por Roland R. Griffiths llevó a cabo un experimento para determinar el grado de la experiencia mística y los efectos de la actitud en el transcurso de la experiencia inducida por la psilocibina. Esto, mediante el uso de una versión modificada del cuestionario y con un doble ciego más riguroso. El estudio fue apoyado por diversos expertos por la solidez de su diseño experimental en la evaluación de los efectos psicológicos producidos por la ingestión de psilocibina.[92] En el experimento, se les administró psilocibina y metilfenidato (Ritalina) en sesiones separadas a 36 voluntarios sin experiencia previa con alucinógenos, las sesiones de metilfenidato sirvieron como control y el mismo como [[sustanci
a placebo]]. El grado de la experiencia mística fue medido mediante la utilización de un cuestionario acerca de las experiencias mísiticas desarrollado por Ralph W. Hood;[93] el 61 % de los sujetos refirieron una «completa experiencia mística» luego de la sesión de psilocibina, mientras que solo el 13 % reportaron el mismo resultado en las sesiones de metilfenidato. Dos meses después de la ingesta de psilocibina, el 79 % de los participantes dijeron haber incrementado moderada o elevadamente su sentido de bienestar. Alrededor del 36 % de los participantes también tuvieron una "experiencia de miedo" de fuerte a extrema (disforia) (esto es, un mal viaje durante la sesión de psilocibina que no fue reportado por ningún sujeto durante la de metilfenidato), con alrededor de un tercio de ellos (13 % del total) que afirmó que la disforia dominó la sesión entera. Tales efectos negativos fueron fácilmente manejados por los investigadores y no tuvieron un efecto negativo duradero en el sentimiento de bienestar de los sujetos.[94] Posteriores mediciones a los 14 meses de la experiencia, confirmaron que los participantes continuaron adjudicando un profundo significado personal a la experiencia.
Estudios posteriores de este mismo grupo investigaron la relación entre la dosis de psilocibina con la probabilidad de una experiencia mística en voluntarios sanos. Un estudio doble ciego mostró que los hongos psicodélicos pueden dar a la gente una experiencia con un importante significado personal y espiritual. En tal estudio, un tercio de los sujetos reportaron que la ingestión de hongos psicodélicos fue el evento espiritualmente más significativo de sus vidas, y cerca de dos tercios lo reportaron entre los cinco eventos espirituales más importantes de sus vidas. Por otro lado, un tercio de los sujetos reportaron extrema ansiedad.[89][95] Investigaciones relacionadas conducidas por este mismo grupo buscan si las experiencias místicas en voluntarios a los que se les administra la psilocibina pueden ayudar con la ansiedad y el estado anímico provocados por el cáncer.[96][97] En el 2017 un estudio demostró que las experiencias de psilocibina trajeron cambios positivos más duraderos cuando se combina con meditación regular.[98][99]
Solo hubo un caso reportado de que la psilocibina y el cannabis probablemente hayan causado un trastorno perceptivo persistente por alucinógenos;[100] aunque los estudios clínicos recientes no muestran tales efectos secundarios.[89]
Posibles efectos psiquiátricos negativos
Las reacciones de pánico pueden desarrollarse tras el consumo de hongos que contienen psilocibina, especialmente si la ingestión es accidental o de alguna forma inesperada. Por ejemplo, reacciones tales como violencia, agresión, intentos homicidas o suicidas,[101] psicosis esquizoide prolongada,[52][102] y convulsiones[103] han sido reportadas en ciertas publicaciones. La similitud de los síntomas inducidos por la psilocibina con aquellos de la esquizofrenia ha llevado a que la droga sea usada en estudios conductuales o de neuroimagen de este trastorno. En ambos casos, se piensa que los síntomas psicóticos surgen de una "activación deficiente de la información sensorial y cognitiva" en el cerebro que finalmente llevan a una "fragmentación cognitiva y psicosis".[104]
Véase también
Referencias
- ↑ a b «List of psychotropic substances under international control» (PDF). Vienna, Austria: International Narcotics Control Board. agosto de 2003. Archivado desde el original el 27 de junio de 2007.
- ↑ a b Wasson RG. (13 de mayo de 1957). «Seeking the magic mushroom». Life (Time Inc.): 101-20. ISSN 0024-3019.
- ↑ a b Heim R. (1957). «Notes préliminaires sur les agarics hallucinogènes du Mexique» [Preliminary notes on the hallucination-producing agarics of Mexico]. Revue de Mycologie (en francés) 22 (1): 58-79.
- ↑ a b Hofmann A, Heim R, Barck A, Kobel H, Frey A, Ott H, Petrzilka T, Troxler F. (1959). «Psilocybin und Psilocin, zwei psychotrope Wirkstoffe aus mexikanischen Rauschpilzen» [Psilocybin and psilocin, two psychotropic substances in Mexican magic mushrooms]. Helvetica Chimica Acta (en alemán) 42: 1557-72.
- ↑ a b Fusar-Poli P, Borgwardt S. (2008). «Albert Hofmann, the father of LSD (1906–2008)» (PDF). Neuropsychobiology 58 (1): 53-4. PMID 18799895. doi:10.1159/000157779.
- ↑ a b Stafford, p. 237.
- ↑ Marley, p. 166.
- ↑ Ott, p. 276.
- ↑ a b Oeric OT, Os ON. (1991). Psilocybin: Magic Mushroom Grower's Guide (2nd edición). San Francisco, California: Quick American Archives. ISBN 978-0932551061.
- ↑ Ott, p. 290.
- ↑ a b Guzmán G, Allen JW, Gartz J. (1998). «A worldwide geographical distribution of the neurotropic fungi, an analysis and discussion» (PDF). Annali del Museo Civico di Rovereto: Sezione Archeologia, Storia, Scienze Naturali 14: 189-280.
- ↑ a b Wurst MM, Semerdzieva M, Vokoun J. (1984). «Analysis of psychotropic compounds in fungi of the genus Psilocybe by reversed-phase high performance liquid chromatography». Journal of Chromatography 286: 229-35. doi:10.1016/S0021-9673(01)99190-3.
- ↑ a b Kysilka R, Wurst M. (1989). «High-performance liquid chromatographic determination of some psychotropic indole derivatives». Journal of Chromatography 464 (2): 434-7. PMID 2722990.
- ↑ a b c Keller T, Schneider A, Regenscheit P, Dirnhofer R, Rücker T, Jaspers J, Kisser W. (1999). «Analysis of psilocybin and psilocin in Psilocybe subcubensis Guzmán by ion mobility spectrometry and gas chromatography-mass spectrometry». Forensic Science International 99 (2): 93-105. PMID 10077856. doi:10.1016/S0379-0738(98)00168-6.
- ↑ a b c Bigwood J, Beug MW. (1982). «Variation of psilocybin and psilocin levels with repeated flushes (harvests) of mature sporocarps of Psilocybe cubensis (Earle) Singer». Journal of Ethnopharmacology 5 (3): 287-91. PMID 7201054. doi:10.1016/0378-8741(82)90014-9.
- ↑ Stafford, p. 248.
- ↑ a b Borowiak KS, Ciechanowski K, Waloszczyk P. (1998). «Psilocybin mushroom (Psilocybe semilanceata) intoxication with myocardial infarction». Journal of Toxicology – Clinical Toxicology 36 (1–2): 47-9. PMID 9541042. doi:10.3109/15563659809162584.
- ↑ a b Gross ST. (2000). «Detecting psychoactive drugs in the developmental stages of mushrooms». Journal of Forensic Sciences 45 (3): 527-37. PMID 10855955.
- ↑ a b Gartz J. (1987). «Occurrence of psilocybin and baeocystin in fruit bodies of Pluteus salicinus». Planta Medica 53 (3): 290-1. PMID 17269025. doi:10.1055/s-2006-962710.
- ↑ a b Stijve T, Kuyper TW. (1985). «Occurrence of psilocybin in various higher fungi from several European countries». Planta Medica 51 (5): 385-7. PMID 17342589. doi:10.1055/s-2007-969526.
- ↑ a b Repke DB, Leslie DT, Guzmán G. (1977). «Baeocystin in Psilocybe, Conocybe and Panaeolus». Lloydia 40 (6): 566-78. PMID 600026.
- ↑ a b Singer R, Smith AH. (1958). «Mycological investigations on Teonanácatl, the Mexican hallucinogenic mushroom. Part II. A taxonomic monograph of Psilocybe, section Caerulescentes». Mycologia 50 (2): 262-303. doi:10.2307/3756197.
- ↑ Stamets, pp. 56–8.
- ↑ a b Horita A, Weber LJ. (1961). «Dephosphorylation of psilocybin to psilocin by alkaline phosphatase». Proceedings of the Society for Experimental Biology 106 (1): 32-3. PMID 13715851.
- ↑ a b Blaschko H, Levine WG. (1960). «A comparative study of hydroxyindole oxidases». British Journal of Pharmacology 15 (4): 625-33. PMC 1482277. PMID 19108143.
- ↑ a b Blaschko H, Levine WG. (1960). «Enzymic oxidation of psilocine and other hydroxyindoles». Biochemical Pharmacology 3 (2): 168-9. doi:10.1016/0006-2952(60)90036-8.
- ↑ a b Kovacic P, Cooksy AL. (2005). «Unifying mechanism for toxicity and addiction by abused drugs: electron transfer and reactive oxygen species». Medical Hypotheses 64 (2): 357-66. PMID 15607571. doi:10.1016/j.mehy.2004.07.021.
- ↑ a b Kovacevic P. (2009). «Unifying electron transfer mechanism for psilocybin and psilocin». Medical Hypotheses 73 (4): 626. PMID 19604649. doi:10.1016/j.mehy.2009.06.022.
- ↑ a b c Anastos N, Barnett NW, Pfeffer FM. (2006). «Investigation into the temporal stability of aqueous standard solutions of psilocin and psilocybin using high performance liquid chromatography». Science & Justice 46 (2): 91-6. doi:10.1016/S1355-0306(06)71579-9.
- ↑ a b c Shirota O, Hakamata W, Goda Y. (2003). «Concise large-scale synthesis of psilocin and psilocybin, principal hallucinogenic constituents of "magic mushroom"». Journal of Natural Products 66 (6): 885-7. PMID 12828485. doi:10.1021/np030059u.
- ↑ a b Troxler F, Seeman F, Hofmann A. (1959). «Abwandlungsprodukte von Psilocybin und Psilocin. 2. Mitteilung über synthetische Indolverbindungen» [Modified products of psilocybin and psilocin. 2. Report on synthetic indole compounds]. Helvetica Chimica Acta (en alemán) 42 (6): 2073-103. doi:10.1002/hlca.19590420638.
- ↑ a b Hofmann A, Frey A, Ott H, Petrzilka T, Troxler F. (1958). «Konstitutionsaufklärung und Synthese von Psilocybin» [The composition and synthesis of psilocybin]. Cellular and Molecular Life Sciences (en alemán) 14 (11): 397-9. doi:10.1007/BF02160424.
- ↑ a b Nichols DE, Frescas S. (1999). «Improvements to the synthesis of psilocybin and a facile method for preparing the o-acetyl prodrug of psilocin». Synthesis 6: 935-8. doi:10.1055/s-1999-3490.
- ↑ a b Beug MW, Bigwood J. (1981). «Quantitative analysis of psilocybin and psilocin in Psilocybe baeocystis (Singer and Smith) by high performance liquid chromatography and by thin layer chromatography». Journal of Chromatography 207 (3): 379-85. PMID 7194879. doi:10.1016/S0021-9673(00)88741-5.
- ↑ a b Sarwar M, McDonald J. (2003). «A rapid extraction and GC/MS methodology for the identification of psilocin in mushroom/chocolate concoctions». Microgram Journal 1 (3–4): 177-83. Archivado desde el original el 29 de abril de 2011.
- ↑ a b Pedersen-Bjergaard S, Sannes E, Rasmussen K, Tonneson F. (1997). «Determination of psilocybin in Psilocybe semilanceata by capillary zone electrophoresis». Journal of Chromatography 694 (2): 375-81. PMID 9252052. doi:10.1016/S0378-4347(97)00127-8.
- ↑ a b Lee RE. (1985). «A technique for the rapid isolation and identification of psilocin from psilocin/psilocybin containing mushrooms». Journal of Forensic Science 30 (3): 931-41. doi:10.1520/JFS11028J.
- ↑ a b Wurst M, Kysilka R, Koza T. (1992). «Analysis and isolation of indole alkaloids of fungi by high-performance liquid chromatography». Journal of Chromatography 593 (1–2): 201-8. doi:10.1016/0021-9673(92)80287-5.
- ↑ a b Saito K, Toyo'oka T, Fukushima T, Kato M, Shirota O, Goda Y. (2004). «Determination of psilocin in magic mushrooms and rat plasma by liquid chromatography with fluorimetry and electrospray ionization mass spectrometry». Analytica Chimica Acta 527 (2): 149-56. doi:10.1016/j.aca.2004.08.071.
- ↑ a b c Lindenblatt H, Kramer E, Holzmann-Erens, Gouzoulis-Mayfrank E, Kovar K. (1998). «Quantitation of psilocin in human plasma by high performance liquid chromatography and electrochemical detection: comparison of liquid-liquid extraction with automated on-line solid-phase extraction». Journal of Chromatography 709 (2): 255-63. PMID 9657222. doi:10.1016/S0378-4347(98)00067-X.
- ↑ a b Rodriguez-Cruz SE. (2005). «Analysis and characterization of psilocybin and psilocin using liquid chromatography-electrospray ionization mass spectrometry (LC-ESI-MS) with collision-induced-dissociation (CID) and source-induced dissociation (SID)». Microgram Journal 3 (3–4): 175-82. Archivado desde el original el 29 de abril de 2011.
- ↑ a b Repke D, Leslie D, Mandell D, Kish N. (1977). «GLC-mass spectral analysis of psilocin and psilocybin». Journal of Pharmaceutical Sciences 66 (5): 743-4. doi:10.1002/jps.2600660539.
- ↑ a b Christiansen AL, Rasmussen KE, Tønnesen F. (1981). «Determination of psilocybin in Psilocybe semilanceata using high performance liquid chromatography on a silica column». Journal of Chromatography 210 (1): 163-7. doi:10.1016/S0021-9673(00)91195-6.
- ↑ a b c Sticht G, Käferstein H. (2000). «Detection of psilocin in body fluids». Forensic Science International 113 (1): 403-7. PMID 10978655. doi:10.1016/S0379-0738(00)00213-9.
- ↑ a b Kysilka R. (1990). «Determination of psilocin in rat urine by high-performance liquid chromatography with electrochemical detection». Journal of Chromatography 534: 287-90. PMID 2094720. doi:10.1016/S0378-4347(00)82176-3.
- ↑ a b c Grieshaber AF, Moore KA, Levine B. (2001). «The detection of psilocin in human urine». Journal of Forensic Sciences 46 (3): 627-30. PMID 11373000.
- ↑ a b Kamata T, Nishikawa M, Katagi M, Tsuchihashi H. (2003). «Optimized glucuronide hydrolysis for the detection of psilocin in human urine samples». The Journal of Chromatography B – Analytical Technologies in the Biomedical and Life Sciences 792 (2): 421-7. doi:10.1016/j.jchromb.2003.08.030.
- ↑ a b Albers C, Köhler H, Lehr M, Brinkmann B, Beike J. (2004). «Development of a psilocin immunoassay for serum and blood samples». International Journal of Legal Medicine 118 (6): 326-31. ISBN 0041400404699
|isbn=incorrecto (ayuda). PMID 15526212. doi:10.1007/s00414-004-0469-9. - ↑ a b Lurie I, Li L. (2009). «Use of high-temperature liquid chromatography with sub-2 µm particle C18 columns for the analysis of seized drugs». Journal of Liquid Chromatography & Related Technologies 32 (17–20): 2615-26. doi:10.1080/10826070903245516.
- ↑ a b c d e f Passie T, Seifert J, Schneider U, Emrich HM. (2002). «The pharmacology of psilocybin». Addiction Biology 7 (4): 357-64. PMID 14578010. doi:10.1080/1355621021000005937.
- ↑ a b Adams JD Jr. (2009). «Chemical Interactions with pyramidal neurons in layer 5 of the cerebral cortex: control of pain and anxiety». Current Medicinal Chemistry 16 (27): 3476-9. PMID 19799545. doi:10.2174/092986709789057626.
- ↑ a b c Vollenweider FX, Vollenweider-Scherpenhuyzen MF, Babler A, Vogel H, Hell D. (1998). «Psilocybin induces schizophrenia-like psychosis in humans via a serotonin-2 agonist action». NeuroReport 9 (17): 3897-902. PMID 9875725. doi:10.1097/00001756-199812010-00024.
- ↑ a b Bray JK, Goddard III WA. (2008). «The structure of human serotonin 2c G-protein coupled receptor bound to agonists and antagonists». Journal of Molecular Graphics and Modelling 27 (1): 66-81. PMID 18499489. doi:10.1016/j.jmgm.2008.02.006.
- ↑ a b González-Maeso J, Sealfon SC. (2009). «Agonist-trafficking and hallucinogens». Current Medicinal Chemistry 16 (8): 1017-27. PMID 19275609. doi:10.2174/092986709787581851.
- ↑ Jacobs, Andrew (15 de mayo de 2021). «Una revolución psicodélica llega a la psiquiatría». The New York Times. ISSN 0362-4331. Consultado el 5 de enero de 2022.
- ↑ a b Wark C, Galliher JF. (2009). «Timothy Leary, Richard Alpert (Ram Dass) and the changing definition of psilocybin». The International Journal on Drug Policy 21 (3): 234-9. PMID 19744846. doi:10.1016/j.drugpo.2009.08.004.
- ↑ a b Moreno FA, Delgado P, Gelenberg AJ. «Effects of Psilocybin in Obsessive-Compulsive Disorder». Multidisciplinary Association for Psychedelic Studies (MAPS). Archivado desde el original el 13 de febrero de 2012. Consultado el 29 de septiembre de 2009.
- ↑ a b Moreno FA, Wiegand CB, Taitano EK, Delgado PL. (2006). «Safety, tolerability, and efficacy of psilocybin in 9 patients with obsessive-compulsive disorder». Journal of Clinical Psychiatry 67 (11): 1735-40. PMID 17196053. doi:10.4088/JCP.v67n1110.
- ↑ Carhart-Harris, Robin L; Roseman, Leor; Bolstridge, Mark; Demetriou, Lysia; Pannekoek, J Nienke; Wall, Matthew B; Tanner, Mark; Kaelen, Mendel et al. (13 de octubre de 2017). «Psilocybin for treatment-resistant depression: fMRI-measured brain mechanisms». Scientific Reports (en inglés) 7 (1). ISSN 2045-2322. doi:10.1038/s41598-017-13282-7. Consultado el 23 de septiembre de 2018.
- ↑ «FDA approves magic mushrooms depression drug trial». Newsweek (en inglés). 23 de agosto de 2018. Consultado el 23 de septiembre de 2018.
- ↑ «The New Science of Psychedelics» (en inglés estadounidense). Consultado el 23 de septiembre de 2018.
- ↑ «COMPASS Pathways Receives FDA Breakthrough Therapy Designation for Psilocybin Therapy for Treatment-resistant Depression – COMPASS» (en inglés estadounidense). Consultado el 7 de diciembre de 2018.
- ↑ «FDA grants Breakthrough Therapy Designation to Usona Institute's psilocybin program for major depressive disorder». www.businesswire.com (en inglés). 22 de noviembre de 2019. Consultado el 25 de noviembre de 2019.
- ↑ a b «Psychopharmacology of Psilocybin in Cancer Patients». ClinicalTrials.gov. U.S. National Institutes of Health. 2009. Consultado el 2011-029-12.
- ↑ a b «Seeking volunteers with a cancer diagnosis to participate in a scientific study of self-exploration and personal meaning». Recruitment notice for psilocybin clinical trial. Johns Hopkins School of Medicine. Archivado desde el original el 7 de agosto de 2008. Consultado el 29 de septiembre de 2009.
- ↑ a b Vollenweider FX, Kometer M. (2010). «The neurobiology of psychedelic drugs: implications for the treatment of mood disorders». Nature Reviews Neuroscience 11 (9): 642-51. PMID 20717121. doi:10.1038/nrn2884.
- ↑ a b Johnson MW, Richards WA, Griffiths RR. (2008). «Human hallucinogen research: guidelines for safety» (PDF). Journal of Psychopharmacology 22 (6): 603-20. PMID 18593734. doi:10.1177/0269881108093587. Archivado desde el original el 20 de noviembre de 2017. Consultado el 7 de mayo de 2011.
- ↑ a b Dodick DW, Rozen TD, Goadsby PJ, Silberstein SD. (2000). «Cluster headache». Cephalgia 20 (9): 787-803. doi:10.1046/j.1468-2982.2000.00118.x.
- ↑ a b Husid MS. (2007). «Cluster headache: A case-based review of diagnostic and treatment approaches». Current Pain and Headache Reports 10 (2): 117-25. PMID 16539864. doi:10.1007/s11916-006-0022-2.
- ↑ a b Sewell RA, Halpern JH, Pope HG Jr. (2006). «Response of cluster headache to psilocybin and LSD». Neurology 66 (12): 1920-2. PMID 16801660. doi:10.1212/01.wnl.0000219761.05466.43.
- ↑ scienceblog (27 de agosto de 2022). «La psilocibina frena el alcoholismo». scienceblog. Consultado el 26 de enero de 2023.
- ↑ a b «Psilocybine: Animal Toxicity Studies». TOXNET—Toxicology Data Network. United States National Library of Medicine, National Institutes of Health. Consultado el 5 de marzo de 2011.
- ↑ a b Nef HM, Möllmann H, Hilpert P, Krause N, Troidl C, Weber M, Rolf A, Dill T, Hamm C, Elsässer A. (2008). «Apical regional wall motion abnormalities reminiscent to Tako-Tsubo cardiomyopathy following consumption of psychoactive fungi». International Journal of Cardiology 134 (1): e39-e41. PMID 18378018. doi:10.1016/j.ijcard.2007.12.064.
- ↑ Stamets, pp. 36–41.
- ↑ a b Baselt RC. (2008). Disposition of Toxic Drugs and Chemicals in Man. Foster City, California: Biomedical Publications. pp. 1346–8. ISBN 0-9626523-7-7.
- ↑ a b Isbell H, Wolbach AB, Wikler A, Miner EJ. (1961). «Cross tolerance between LSD and psilocybin». Psychopharmacologia 2 (3): 147-59. PMID 13717955. doi:10.1007/BF00407974.
- ↑ a b Abramson HA, Rolo A. (1965). «Lysergic acid diethylamide (LSD-25). 38. Comparison with action of methysergide and psilocybin on test subjects». The Journal of Asthma Research 3 (1): 81-96. PMID 5318626. doi:10.3109/02770906509106904.
- ↑ a b Beck O, Helander A, Karlson-Stiber C, Stephansson N. (1998). «Presence of phenylethylamine in hallucinogenic Psilocybe mushroom: possible role in adverse reactions». Journal of Analytical Toxicology 22 (1): 45-9. PMID 9491968.
- ↑ a b Chen C-Y, Storr CL, Anthony JC. (2008). «Early-onset drug use and risk for drug dependence problems». Addictive Behaviors 34 (3): 319-22. PMC 2677076. PMID 19022584. doi:10.1016/j.addbeh.2008.10.021.
- ↑ a b Leary T, Litwin GH, Metzner R. (1963). «Reactions to psilocybin administered in a supportive environment». Journal of Nervous and Mental Disease 137: 561-73. PMID 14087676.
- ↑ a b Berge JT. (1999). «Breakdown or breakthrough? A history of European research into drugs and creativity». Journal of Creative Behavior 33 (4): 257-76. ISSN 0022-0175.
- ↑ a b Hasler F, Grimberg U, Benz MA, Huber T, Vollenweider FX. (2004). «Acute psychological and physiological effects of psilocybin in healthy humans: a double-blind, placebo-controlled dose-effect study». Psychopharmacology 172 (2): 145-56. PMID 14615876. doi:10.1007/s00213-003-1640-6.
- ↑ a b Peden NR, Macaulay KEC, Bissett AF, Crooks J, Pelosi AJ. (1981). «Clinical toxicology of "magic mushroom" ingestion». Postgraduate Medical Journal 57 (671): 543-5. PMC 2426147. PMID 7199140. doi:10.1136/pgmj.57.671.543.
- ↑ See for example:
- Isbell H. (1959). «Comparison of the reactions induced by psilocybin and LSD-25 in man». Psychopharmacologia 1 (1): 29-38. PMID 14405870. doi:10.1007/BF00408109.
- Hollister LE, Prusmack JJ, Paulsen A, Rosenquist N. (1960). «Comparison of three psychotropic drugs (psilocybin, JB-329, and IT-290) in volunteer subjects». Journal of Nervous and Mental Disease 131 (5): 428-34. PMID 13715375. doi:10.1097/00005053-196011000-00007.
- Malitz S, Esecover H, Wilkens B, Hoch PH. (1960). «Some observations on psilocybin, a new hallucinogen, in volunteer subjects». Comprehensive Psychiatry 1: 8-17. PMID 14420328. doi:10.1016/S0010-440X(60)80045-4.
- Rinkel M, Atwell CR, Dimascio A, Brown J. (1960). «Experimental psychiatry. V. Psilocybine, a new psychotogenic drug». New England Journal of Medicine 11 (262): 295-7. PMID 14437505. doi:10.1056/NEJM196002112620606.
- Parashos AJ. (1976). «The psilocybin-induced "state of drunkenness" in normal volunteers and schizophrenics». Behavioral Neuropsychiatry 8 (1–12): 83-6. PMID 1052267.
- ↑ a b Fischer R, England SM, Archer RC, Dean RK. (1966). «Psilocybin reactivity and time contraction as measured by psychomotor performance». Arzneimittelforschung 16 (2): 180-5. PMID 6014013.
- ↑ a b Wittmann M, Carter O, Hasler F, Cahn BR, Grimberg U, Spring P, Hell D, Flohr H, Vollenweider FX. (2007). «Effects of psilocybin on time perception and temporal control of behaviour in humans». Journal of Psychopharmacology (Oxford) 21 (1): 50-64. PMID 16714323. doi:10.1177/0269881106065859.
- ↑ a b Wackermann J, Wittmann M, Hasler F, Vollenweider FX. (2008). «Effects of varied doses of psilocybin on time interval reproduction in human subjects». Neuroscience Letters 435 (1): 51-5. PMID 18325673. doi:10.1016/j.neulet.2008.02.006.
- ↑ a b Pahnke WN. (1966). «Drugs and mysticism». International Journal of Parapsychology 8 (2): 295-315.
- ↑ a b c d Griffiths R, Richards W, Johnson M, McCann U, Jesse R. (2008). «Mystical-type experiences occasioned by psilocybin mediate the attribution of personal meaning and spiritual significance 14 months later» (PDF). Journal of Psychopharmacology 22 (6): 621-32. PMID 18593735. doi:10.1177/0269881108094300. Archivado desde el original el 22 de julio de 2008. Consultado el 7 de mayo de 2011.
- ↑ Doblin, p. 13.
- ↑ Doblin, p. 24.
- ↑ The academic communities' approval for the methodology employed is exemplified by the quartet of commentaries published in the journal Psychopharmacology:
- Kleber HD. (2006). «Commentary on: Psilocybin can occasion mystical-type experiences having substantial and sustained personal meaning and spiritual experience by Griffiths et al.» (PDF). Psychopharmacology 187 (3): 291-2. doi:10.1007/s00213-006-0461-9.
- Nichols DE. (2006). «Commentary on: Psilocybin can occasion mystical-type experiences having substantial and sustained personal meaning and spiritual experience by Griffiths et al.» (PDF). Psychopharmacology 187 (3): 284-6. doi:10.1007/s00213-006-0458-4.
- Schuster CR. (2006). «Commentary on: Psilocybin can occasion mystical-type experiences having susbstantial and sustained personal meaning and spiritual significance by Griffiths et al.» (PDF). Psychopharmacology 187 (3): 289-90. doi:10.1007/s00213-006-0460-x.
- Snyder SH. (2006). «Commentary on: Psilocybin can occasion mystical-type experiences having susbstantial and sustained personal meaning and spiritual significance by Griffiths et al.» (PDF). Psychopharmacology 187 (3): 287-8. doi:10.1007/s00213-006-0459-3.
- ↑ a b Hood RW Jr. (1975). «The construction and preliminary validation of a measure of peported mystical experience». Journal for the Scientific Study of Religion 14 (1): 29-41. (requiere suscripción)
- ↑ a b Smith M. (12 de julio de 2006). «Medical News: Psilocybin Viewed as Therapy or Research Tool». Medpagetoday.com. Archivado desde el original el 5 de octubre de 2008. Consultado el 12 de febrero de 2011.
- ↑ a b Weil A. (16 de octubre de 2006). «Looking for Mushroom Magic?». drweil.com. Consultado el 12 de febrero de 2011.
- ↑ a b Grob CS, Danforth AL, Chopra GS, Hagerty M, McKay CR, Halberstadt AL, Greer GR. (2011). «Pilot study of psilocybin treatment for anxiety in patients with advanced-stage cancer». Archives of General Psychiatry 68 (1): 71-8. PMID 20819978. doi:10.1001/archgenpsychiatry.2010.116.
- ↑ Schiffman, Richard. «Psilocybin: A Journey beyond the Fear of Death?». Scientific American (en inglés). Consultado el 21 de febrero de 2019.
- ↑ «Psilocybin (from magic mushrooms) plus meditation and spiritual training leads to lasting changes in positive traits». Research Digest (en inglés). 19 de enero de 2018. Archivado desde el original el 21 de febrero de 2019. Consultado el 21 de febrero de 2019.
- ↑ Smigielski, Lukasz; Scheidegger, Milan; Kometer, Michael; Vollenweider, Franz X. (1 de agosto de 2019). «Psilocybin-assisted mindfulness training modulates self-consciousness and brain default mode network connectivity with lasting effects». NeuroImage 196: 207-215. ISSN 1053-8119. doi:10.1016/j.neuroimage.2019.04.009. Consultado el 27 de septiembre de 2019.
- ↑ a b Espiard ML, Lecardeur L, Abadie P, Halbecq I, Dollfus S. (2005). «Hallucinogen persisting perception disorder after psilocybin consumption: a case study». European Journal of Psychiatry 20 (5–6): 458-60. PMID 15963699. doi:10.1016/j.eurpsy.2005.04.008.
- ↑ a b Peden NR, Pringle SD, Crooks J. (1982). «The problem of psilocybin mushroom abuse». Human Toxicology 1 (4): 417-24. PMID 7173927. doi:10.1177/096032718200100408.
- ↑ a b Hyde C, Glancy P, Omerod P, Hall D, Taylor GS. (1978). «Abuse of indigenous psilocybin mushrooms: a new fashion and some psychiatric complications». British Journal of Psychiatry 132: 602-4.
- ↑ a b Mack RB. (1983). «Phenomenally phunny phungi – psilocybin toxicity». New Castle Medical Journal 44 (10): 639-40. PMID 6580536.
- ↑ a b Vollenweider FX, Geyer MA. (2001). «A systems model of altered consciousness: integrating natural and drug-induced psychoses». Brain Research Bulletin 56 (5): 495-507. PMID 11750795. doi:10.1016/S0361-9230(01)00646-3.
- ↑ Attema-de Jonge ME, Portier CB, Franssen EJF. (2007). «Automutilatie na gebruik van hallucinogene paddenstoelen» [Automutilation after consumption of hallucinogenic mushrooms]. Nederlands Tijdschrift voor Geneeskunde (en neerlandés) 151 (52): 2869-72. PMID 18257429.
- ↑ Frecska E, Luna LE. (2006). «The adverse effects of hallucinogens from intramural perspective» (PDF). Neuropsychopharmacolia Hungarica 8 (4): 189-200. PMID 17211054.
- ↑ Giannini AJ. (1997). Drugs of Abuse—Second Edition. Los Angeles, California: Practice Management Information Corporation. ISBN 978-1570660535.
- ↑ «List of psychotropic substances under international control» (PDF) (23rd edición). Vienna, Austria: International Narcotics Control Board. 2003. Archivado desde el original el 27 de junio de 2007.
Fuentes
- En inglés
- Boire RG. (2002). Sacred Mushrooms and the Law. Berkeley, California: Ronin Publishing. ISBN 978-1579510619.
- Doblin R. (1991). «Pahnke's "Good Friday Experiment": A long-term follow-up and methodological critique» (PDF). Journal of Transpersonal Psychology 23 (1): 1-25. Archivado desde el original el 16 de agosto de 2012.
- Marley G. (2010). «Chapter 13. Psilocybin: Gateway to the Soul or Just a Good High?». Chanterelle Dreams, Amanita Nightmares: The Love, Lore, and Mystique of Mushrooms. White River Junction, Vermont: Chelsea Green Publishing. pp. 163–84. ISBN 1-60358-214-2.
- Ott J. (1993). Pharmacotheon Entheogenic Drugs Their Plant Sources and Histories. Kennewick, Washington: Natural Products Company. ISBN 978-0961423438.
- Stafford PJ. (1992). Psychedelics Encyclopedia. Berkeley, California: Ronin Publishing. ISBN 0-914171-51-8.
- Stamets P. (1996). Psilocybin Mushrooms of the World: An Identification Guide. Berkeley, California: Ten Speed Press. ISBN 0-89815-839-7.
- Michael Pollan (2018). Cómo cambiar tu mente: Lo que la nueva ciencia de la psicodelia nos enseña sobre la conciencia, la muerte, la adicción, la depresión y la transcendencia. Barcelona: Debate. ISBN 9788499929064.
