En química orgánica, una reacción pericíclica es una reacción concertada en la que el estado de transición tiene una geometría cíclica. Las reacciones pericíclicas suelen ser reacciones de transposición. Una reacción pericíclica puede ser catalogada como:
| Nombre | Cambios de enlaces | |
|---|---|---|
| Sigma | Pi | |
| Reacción electrocíclica | + 1 | -1 |
| Cicloadición | +2 | -2 |
| Reacción sigmatrópica | 0 | 0 |
| Reacción de transferencia de grupo | + 1 | -1 |
| Reacción quelotrópica | + 2 | - 2 |
| Reacción diotrópica | 0 | 0 |
En general, se considera que estas reacciones están en equilibrio químico, aunque es posible desplazar el equilibrio en una dirección, diseñando una reacción en la que el producto tenga un contenido energético significativamente menor; esto es debido a una interpretación unimolecular del principio de Le Châtelier, por lo que existe un grupo de reacciones retropericíclicas.
Mecanismo
Frecuentemente, las reacciones pericíclicas tienen pasos relacionados asociados con procesos de radicales. Algunas reacciones pericíclicas, como las cicloadiciones [2+2], son 'controversiales', porque no se conoce definitivamente si su mecanismo es concertado, o pueda depender del sistema reactante. Las reacciones pericíclicas suelen tener análogos catalizados por metales, aunque generalmente estas no son técnicamente pericíclicas, dado que proceden vía intermediarios estabilizados por el metal, y por tanto no son concertadas.
La teoría del estado de transición aromático asume que el estado de transición de mínima energía para un proceso pericíclico es aromático. Para reacciones que involucran a sistemas de 4n+2 electrones π (2,6,10... electrones), se han propuesto estados de transición de tipo Huckel donde la porción reactiva de la molécula presenta una estructura geométrica plana. En sistemas 4n π (4,8,12... electrones) se han propuesto estados de transición de Mobius, lo que implica un giro para ser aromáticos o requieren de un nodo.
La reacción pericíclica más 'grande' fue un cierre de anillo [14 pi] en una corrina, llevada a cabo por Albert Eschenmoser.
Debido al principio de reversibilidad microscópica, hay un conjunto paralelo de reacciones "retro" pericíclicas, que llevan a cabo la reacción inversa.
Reacciones pericíclicas en estereoquímica
Se encuentra bien establecido que un dieno solo puede entrar en una reacción de cicloadición con un dienófilo en la forma cisoide y que la tasa de reacción con las cadenas abiertas de dieno dependen del las proporciones de equilibrio de los confórmeros cisoide/transoide. Por lo tanto los sustituyentes en el dieno pueden afectar significativamente la tasa de reacción son solo por su carácter electrónico sino también por su influenica en las proporciones relativas de los diferentes confórmeros.
Así, por ejemplo el butadieno cis sustituido es menos reactivo que su isómero II, ya que una conformacióncon un sustituyente R voluminoso desfavorece la conformación cisoide. Los sustituyentes voluminosos en la posición 2 del dieno favorecen conformación cisoide más que la transoide, y por lo tanto en este caso el dieno es más reactivo.[1]
Reacciones pericíclicas en bioquímica
Las reacciones pericíclicas también están presentes en procesos bioquímicos.
- Rearreglo de Claisen del corismato a prefenato en casi todos los organismos protótrofos.
- Desplazamiento sigmatrópico-[1,5] en la transformación de precorrin-8x a ácido hidrogenobirínico.
- Apertura electrocíclica fotoquímica y no enzimática de un anillo, y desplazamiento sigmatrópico [1,7] de un hidruro en la síntesis de vitamina D.
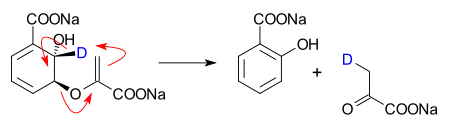
- Conversión de isocorismato en salicilato y piruvato en una verdadera reacción pericíclica catalizada[2][3]
Véase también
Referencias
- ↑ An Introduction to Orbital Symmetry and Pericyclic Reactions 2006 - Prof. Dr. Fathy Mohamed Abdelrazek
- ↑ Isochorismate Pyruvate Lyase: A Pericyclic Reaction Mechanism? Michael S. DeClue, Kim K. Baldridge, Dominik E. Künzler, Peter Kast, and Donald Hilvert J. Am. Chem. Soc.; 2005; 127(43) pp 15002 - 15003; (Communication) DOI: 10.1021/ja055871t Abstract
- ↑ En este experimento, el isocorimato es deuterado en una posición específica y sometido a la liasa. Dos observaciones clave eliminan el mecanismo de reacción iónico o promovido por bases. Del efecto cinético isotópico (valor 2,34) puede inferirse que la ruptura del enlace carbono-hidrógeno sucede en el estado de transición de la etapa determinante de la reacción. La espectroscopia NMR muestra que el átomo de deuterio es transferido exclusivamente a la molécula de piruvato.