En química un nucleófilo es una especie que reacciona cediendo un par de electrones libres a otra especie (el electrófilo), combinándose y enlazándose covalentemente con ella. Un nucleófilo, concepto cinético, es también por definición una base de Lewis, concepto termodinámico. Un nucleófilo puede ser un anión o una molécula neutra con un par de electrones libres.
Los nucleofilos ambidentados son aquellos que tienen dos posibles centros de reacción. Por ejemplo el tiocianato (SCN-).
YouTube Encyclopedic
-
1/3Views:102 22056 23224 191
-
¿QUÉ ES UN NUCLEÓFILO? | Química Orgánica
-
Identificar centros nucleofílicos y electrofílicos | Química orgánica | Khan Academy en Español
-
NUCLEOFILIA VS BASICIDAD | Química Orgánica
Transcription
Nucleofilia
La nucleofilia es la fuerza como nucleófilo de una especie. Es un concepto cinético, por tanto se mide comparando constantes de velocidad. En la nucleofilia influyen la carga, la basicidad, la polarizabilidad e impedimentos estéricos del nucleófilo y la naturaleza del disolvente. Intuitivamente, en general, la nucleofilia aumenta con la carga negativa, la basicidad y la polarizabilidad y disminuye por impedimento estérico y con la mayor solvatación (mejor un disolvente polar aprótico).
Para entenderlo mejor unos ejemplos:
- Efecto de la carga:
- HO- > H2O;
- NH2- > NH3
- Efecto de la basicidad:
- NH3 > H2O;
- NH2- > HO-;
- CH3S- > Cl-
Podemos ver en estos ejemplos como la nucleofilia disminuye hacia la derecha de la tabla periódica.
- Efecto de la polarizabilidad y del disolvente:
- I- > Br- > Cl-
El anión yoduro con una "nube electrónica" más voluminosa es más polarizable. El anión cloruro más pequeño además es solvatado mejor por el disolvente.
- El efecto de la polarizabilidad, del tamaño del átomo nucleófilo, se observa claramente en especies neutras donde el efecto de la solvatación no es tan importante como en las especies cargadas:
- PH3 > NH3; H2Se > H2S > H2O
Podemos ver con este ejemplo como la nucleofilia aumenta al descender por la tabla periódica.
- El efecto del impedimento estérico:
- CH3O- > (CH3)3CO-
Reactividad
Sustitución nucleófila
En este tipo de reacciones un átomo o grupo es sustituido en el sustrato por el nucleófilo. Por ejemplo la reacción de un haluro de alquilo primario con el ion hidróxido:

Adición nucleófila
El nucleófilo se adiciona a un grupo electrófilo. Por ejemplo la reacción de los reactivos de Grignard con cetonas:
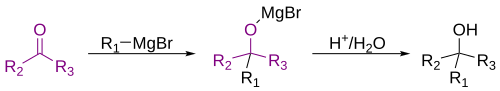
Ejemplos
Nucleófilos de carbono
Lo son reactivos organometálicos como los reactivos de Grignard o reactivos de alquil-litio. Lo son en general los carbaniones.
Nucleófilos de oxígeno
Lo son el agua y los alcoholes. Cuando como disolventes actúan en sustituciones nucleófilas se llama a la reacción solvólisis, (hidrólisis y alcohólisis respectivamente). También lo son sus respectivos aniones como el hidróxido (-OH) y los alcóxidos. Sales de ácidos carboxílicos.
Nucleófilos de nitrógeno
El amoniaco (NH3) y las aminas.
Nucleófilos de azufre
El anión hidrogenosulfuro (HS-) y los tioles (R-SH), tiolatos (R-S-) y sulfuros (R-S-R).
Véase también
Bibliografía
- Diego RIZO (05/01/2005). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
