Las moléculas anfifílicas, también llamadas anfipáticas, son aquellas moléculas que poseen un extremo hidrofílico, es decir, que es soluble en agua, y otro que es hidrófobo, lo cual significa que rechaza el agua.[1] Así, por ejemplo, cualquier tipo de aceite es hidrófobo porque no puede incorporarse al agua. Comúnmente estas dos partes tenderían a separarse si se agregan a una mezcla de dos sustancias, una hidrofóbica y una hidrofilica, lo que no puede cumplirse debido a que se encuentran unidas por un enlace químico.
A estos compuestos que contienen grupos simultáneos fuertemente no polares y grupos fuertemente polares, el agua los dispersa o los solubiliza formando micelas, bicapas o monocapas. Un ejemplo sencillo de biomolécula anfifílica que tiende a formar micelas es la sal sódica del ácido oleico. Esta molécula posee un solo grupo carboxilo que es polar y tiende por ello a hidratarse con facilidad, y una larga cola hidrocarbonada, que es no polar e intrínsecamente insoluble en el agua.
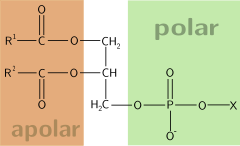
Otro ejemplo son los fosfolípidos, compuestos por dos ácidos grasos, los extremos hidrófobos; y un ácido fosfórico y un aminoalcohol (el extremo hidrófilo). Este también es el caso de los jabones, ya que las moléculas de jabón se adhieren por un lado a las moléculas de agua y por el otro a las partículas de suciedad.
Los triglicéridos no son anfipáticos, no son solubles en agua o sea no cumplen con la doble característica de ser solubles en solventes orgánicos (no polares) y en el agua (polar). No es anfipatica ya que las partes polares de la glicerina y de los ácidos grasos están formando parte de los enlaces ester. El triglicérido, a diferencia del fosfolípido, no tiene el grupo fosfato que es el que, precisamente, le confiere esa característica anfipática
YouTube Encyclopedic
-
1/3Views:76 53813 959150 525
-
Micelas y moléculas anfipáticas o anfifílicas
-
Moléculas anfipáticas ou anfifílicas - Química em segundos
-
Moleculas polar y no polar. Hidrofóbico e hidrofílico EN 2 MINUTOS!
Transcription
Estructura hidrofóbica (o no polar)
En una molécula no polar los electrones compartidos están igualmente atraídos por los dos átomos. Estos enlaces se forman entre átomos con valores de electronegatividad similares. Estas moléculas coadyuvan al proceso de generación de micelas así como para transportar los lípidos.
Estructura hidrofílica (o polar)
Cuando hay un enlace entre dos tipos de átomos diferentes se tiene una molécula polar. Este enlace se presenta debido a que los dos átomos tienen diferentes electronegatividades. Por polar se entiende una distribución desigual de carga eléctrica.
Interacciones hidrofóbicas
Se denominan interacciones hidrofóbicas a aquellas fuerzas que mantienen juntas las regiones apolares de las moléculas, refiriéndose éstas a la asociación de las porciones hidrofóbicas de las moléculas anfifílicas. En comparación con los enlaces de hidrógeno, las interacciones hidrofóbicas poseen poco carácter direccional, pero tienden a producir sistemas de elevada estabilidad. La fuerza de estas interacciones no se debe a ninguna atracción intrínseca entre las partes apolares. Recibe también el nombre de efecto hidrofóbico, y este se resume como el conjunto de factores termodinámicos que son responsables del agrupamiento de las partes no polares de un medio acuoso.
Micelas
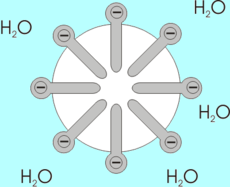
Cuando se agita una mezcla de agua y ácido oleico en su forma COOH, el resultado es una suspensión blanca y turbia que dura tan solo unos minutos antes de volver a separarse en las dos fases originales. Esa suspensión consta de partículas esféricas, llamadas micelas, las cuales se forman por efectos hidrofóbicos. Cuando las moléculas de ácido oleico se mezclan inicialmente con el agua, algunas de las moléculas de esta última se orientan en torno a cada molécula de ácido oleico, y entablan con ella interacciones de tipo dipolo. En esta estructura la parte no polar forma la parte central y hacia el exterior se sitúa la parte polar que por sus características puede interactuar con el agua.
Aplicaciones
La tecnología denominada sonolisis administra en el torrente sanguíneo micro burbujas encapsuladas en micelas grasas. Esta tecnología junto con los ultrasonidos son un avance para la prevención de infartos.
Tensoactivos
Una de las manifestaciones de los tensoactivos es la propiedad de formar micelas. La naturaleza de estas sustancias es anfifilica, por tanto se absorben en interfases. En una interfaz aire-agua, la parte hidrofóbica del tensoactivo es dirigida hacia arriba en el aire y la parte hidrofílica se asocia con la superficie del agua. La parte hidrofílica del tensoactivo tiende a quedarse en la superficie porque la otra parte tiende a estar en contacto con el aire, este hecho hace que las moléculas del agua en la superficie se desplacen abajo de la superficie haciendo que la tensión superficial del agua disminuye. Los jabones son, en general, sales orgánicas que contienen una parte polar capaz de interaccionar y disolverse en el agua, por lo que se dice que es una parte hidrófila, y la otra apolar, que es hidrófoba o lipofílica (es decir, con tendencia a interaccionar con las grasas y otros compuestos orgánicos apolares).
Desafortunadamente los tensoactivos de los detergentes son unos de los mayores contaminantes de las aguas residuales; para contrarrestar dicho daño ambiental, el Instituto Investigaciones Químicas y Ambientales del CSIC en Barcelona y dirigido por Damià Barceló, trabaja en la construcción de un sensor llamado ELISA, el cual con el uso de anticuerpos revela qué cantidad de tensoactivo hay en el agua, también ayuda a determinar los metabolitos de los “linear alquilbenzenosulfonatos” que son los tensioactivos más usados en los detergentes de uso doméstico.[2]
Liposoma
Hay varios tipos de materiales lípídicos anfipáticos que pueden mezclarse con agua en condiciones específicas para formar liposomas. A diferencia del compacto agrupamiento de las estructuras apolares en el centro de la micela, en un liposoma los lípidos apolares se agrupan lado a lado formando dos capas, de modo que integran esferas bicapa concéntricas que envuelven por completo una región interna de agua.
Investigaciones en curso
Gracias a investigaciones se está creando moléculas capaces de incorporar en el interior de su estructura fármacos encapsulados, como lo son los polímeros cristal-líquido colestéricos. Dichos polímeros son capaces de transportar y atrapar moléculas de menor tamaño gracias a sus moléculas anfifílicas que se autoasocian. Actualmente su estudio se basa en el transporte de fármacos específicos y biomacromoléculas.[3]
Producción de óxidos metálicos
Los tensioactivos se utilizan actualmente en la obtención de óxidos metálicos mesoporosos, los tensioactivos agregados a la solución normal de sol-gel en la obtención de dichos óxidos, forman esferas y estructuras hexagonales parecidas a los panales de abeja, que al agregar alcóxido forman un gel, por lo que el tensoactivo desaparece dejando un poro.
Dicho avance se logró gracias a las investigaciones de la Universidad Autónoma Metropolitana.[4]
Referencias
- ↑ «Anfipática. Diccionario médico. Clínica Universidad de Navarra.». www.cun.es. Consultado el 20 de junio de 2021.
- ↑ [1] Solociencia.com
- ↑ [2] SERINA.ES
- ↑ Ciencia y Tecnología - :: Investigación y Desarrollo :: Periodismo en Salud, Ciencia y Tecnología :: México
Bibliografía
- BOHINSKI, Robert C. “Bioquímica”. Editorial Adisson Wesley. Quinta edición. Págs.: 40-46
- NELSON, David L.; COX, Michael. “Principios de Bioquímica” Ediciones Omega. Tercera edición. Págs.: 86-90, 392-395.
- TORRES, Héctor N. “Bioquímica General”. Editorial El Ateneo. Págs.: 85-90.
- NELSON, Philip. “Física Biológica: energía, información y vida”. Editorial Reverté. 2005. Págs.: 317-364.
