| Hexaflouoruro de uranio | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
|
Hexaflouoruro de uranio Fluoruro de uranio(VI) | ||
| General | ||
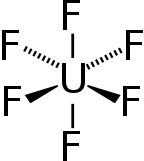
| Fórmula semidesarrollada | UF6 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7783-81-5[1] | |
| Número RTECS | YR4720000 | |
| ChEBI | 30235 | |
| ChemSpider | 22966 | |
| PubChem | 24560 | |
| UNII | N06GJ1D94J | |
|
F[U](F)(F)(F)(F)F
| ||
| Propiedades físicas | ||
| Apariencia | Sólido incoloro | |
| Densidad | 5,09 kg/m³; 0,00509 g/cm³ | |
| Masa molar | 35 202 g/mol | |
| Peligrosidad | ||
| NFPA 704 |
0
4
2
W+OX
| |
| Frases R | R26/28, R33, R51/53 | |
| Frases S | S1/2, S20/21, S45, S61 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||

El Hexafluoruro de uranio es el gas más pesado conocido. Su fórmula es UF6. Este se forma por la combinación de fluoruro o silicato con el uranio.
YouTube Encyclopedic
-
1/1Views:5 801
-
El Valle Nuclear, Uranio en Valles Calchaquíes, Rodriguez Pardo. Argentina.
Transcription
Síntesis
La síntesis inicial de hexafluoruro de uranio fue realizada por Otto Ruff y Alfred Heinzelmann en 1909. Esta síntesis tuvo lugar en un tubo de platino a -20 °C con exclusión de la humedad mediante la reacción del cloruro de uranio con flúor.[2]
Los mismos autores presentaron una primera descripción general del hexafluoruro de uranio al Journal of Inorganic Chemistry en 1911.7[3] Además de la síntesis presentada anteriormente, se presentaron dos variantes más y se describieron algunas propiedades y reacciones.
La reacción del cloruro de uranio con fluoruro de hidrógeno (HF) no es adecuada para la preparación de UF6 puro, ya que es difícil de separar del HF.[4]
Si se permite que el uranio metálico o el dicarburo de uranio (UC2) reaccione con el flúor (en presencia de pequeñas cantidades de cloro como catalizador), se puede observar una conversión completa en UF6.[4]
Usos
Gracias a lo pesado de sus moléculas es posible utilizar el centrifugado para separar los isótopos 235U y 238U, obteniendo de esta manera uranio enriquecido.
Toxicidad
El hexafluoruro de uranio es muy tóxico y —dependiente del isótopo del uranio— más o menos radiactivo. Encontrándose en agua —también con el fluido corporal—, hexafluoruro de uranio produce el ácido fluorhídrico muy corrosivo.
Enlaces externos
Referencias
- ↑ Número CAS
- ↑ Otto Ruff: Über einige neue Fluoride; in: Chem. Ber., 1909, 42 (1), S. 492–497, hier S. 495–497 (doi:10.1002/cber.19090420175).
- ↑ Alfred Heinzelmann: Das Uranhexafluorid, ein Beitrag zur Kenntnis des sechswertigen Urans (Dissertation, Danzig, 27. Juni 1911), 55 S. (Digitalisat).
- ↑ a b Otto Ruff, Alfred Heinzelmann: Über das Uranhexafluorid; in: Zeitschrift für anorganische Chemie, 1911, 72 (1), S. 63–84 (doi:10.1002/zaac.19110720106).




