Триптофа́новый оперо́н — оперон, содержащий гены ферментов, задействованных в биосинтезе аминокислоты триптофан. Триптофановый оперон имеется у многих бактерий, впервые был описан у Escherichia coli. Триптофановый оперон является важной экспериментальной моделью для изучения регуляции экспрессии генов.
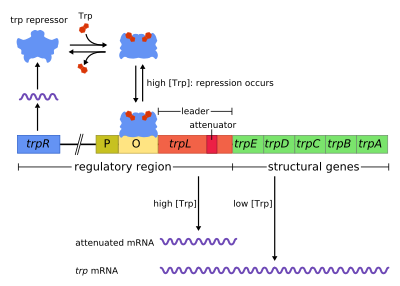
Триптофановый оперон был описан в 1953 году Жаком Моно и сотрудниками. Он стал первым опероном, для которого была показана регуляция посредством репрессии. В то время как лактозный оперон активируется веществом, на утилизацию которого он направлен (лактозой), триптофановый оперон подавляется триптофаном — соединением, за биосинтез которого ответственен данный оперон. Он содержит 5 структурных генов (цистронов): trpE, trpD, trpC, а также trpB и trpA, кодирующие субъединицы триптофансинтазы. На значительном расстоянии от оперона находится ген trpR, кодирующий белок, подавляющий экспрессию триптофанового оперона. Продукт этого гена в присутствии триптофана связывается с оператором и блокирует транскрипцию оперона. В отличие от lac-оперона, в состав trp-оперона входит особая последовательность — аттенюатор, необходимая для тонкой регуляции транскрипции оперона.
Регуляция
Регуляция триптофаного оперона осуществляется двумя способами: с помощью белка-репрессора (репрессия), а также с помощью особой последовательности — аттенюатора. При этом в каждом из этих случаев регуляция осуществляется по принципу отрицательной обратной связи.
Репрессия

Белок-репрессор (триптофановый репрессор) имеет молекулярную массу 58 кДа, кодируется геном trpR, расположенным на значительном расстоянии от самого оперона. Ген trpR непрерывно экспрессируется на невысоком уровне, образуя мономеры, которые затем объединяются в димеры. В отсутствие триптофана эти димеры неактивны и распадаются в цитоплазме. Однако если концентрация триптофана в клетке высока, то димеры связываются с триптофаном. При этом происходит изменение конформации репрессора, позволяющее ему связаться с оператором. В данном случае существенно, что в триптофановом опероне нуклеотидные последовательности оператора и промотора перекрываются, так что присоединение комплекса L-триптофан•белок-репрессор автоматически блокирует связывание РНК-полимеразы с промотором. Таким образом, транскрипция триптофанового оперона блокируется[1].
Аттенюация

Аттенюация является вторым механизмом регуляции trp-оперона. Этот способ регуляции возможен потому, что у прокариот, лишённых ядра, процессы транскрипции и трансляции не разделены во времени и пространстве, как у эукариот, и идут одновременно: пока РНК-полимераза синтезирует мРНК, синтезированный участок этой мРНК транслируется рибосомой. В связи с этим процесс трансляции может оказывать непосредственное влияние на транскрипцию оперона.
Сразу после оператора в триптофановом опероне располагается последовательность длиной 162 п. н.[2], получившая название лидерной последовательности. Она кодирует так называемый лидерный пептид, который получил такое название, поскольку с полицистронной мРНК триптофанового оперона этот пептид синтезируется первым. В состав лидерной последовательности входит особая аттенюаторная последовательность (аттенюатор), которая, влияя на вторичную структуру синтезируемой мРНК, способна вызывать преждевременную терминацию транскрипции. Аналогичная последовательность имеется также у бактерий рода Salmonella[3].
В trp-опероне Escherichia coli аттенюатор имеет 4 области с обращёнными повторами. Транскрипция аттенюатора приводит к образованию шпилек в мРНК. Возможны 3 варианта шпилек, а именно между последовательностями: 1—2, 2—3, 3—4. При этом образование шпильки 1—2 блокирует образование шпильки 2—3, а образование шпильки 2—3, в свою очередь, препятствует образованию шпильки 3—4. Только шпилька 3—4 является терминаторной, то есть при её образовании РНК-полимераза с высокой вероятностью диссоциирует от ДНК, и транскрипция прерывается.
Часть лидерного транскрипта кодирует короткий пептид длиной 14 аминокислотных остатков — лидерный пептид. Этот пептид содержит 2 располагающихся друг за другом триптофановых остатка. Триптофан — редкая аминокислота (на 100 остатков аминокислот белка Escherichia coli приходится 1 триптофановый остаток), в условиях нехватки триптофана внутриклеточная концентрация комплекса W-tRNATrp•EF-Tu•GTP становится очень низкой и рибосома начинает «зависать» на триптофановых кодонах, так как соответствующий комплекс не может «найтись» быстро. Останавливаясь на двух триптофановых кодонах, рибосома закрывает первую из 4 областей обращённых повторов. Из-за этого образуется шпилька 2—3, а терминаторная шпилька 3—4 не образуется, и транскрипция продолжается дальше в область структурных генов. Итак, в условиях недостатка триптофана ферменты, необходимые для его синтеза, образуются[3].
Если же концентрация триптофана высока, то «зависания» рибосомы на триптофановых кодонах не происходит: необходимый комплекс триптофанил-тРНКTrp находится быстро. В этом случае рибосома закрывает уже не одну первую, а две первые области обращённых повторов. Остаются свободными области 3 и 4, из-за чего формируется терминаторная шпилька 3—4, а значит, транскрипция останавливается. В итоге образуется лишь короткий нефункциональный пептид. Таким образом, в условиях избытка триптофана ферменты, необходимые для его синтеза, не образуются[3].
Для правильной работы аттенюатора чрезвычайно важна одновременность процессов транскрипции и трансляции лидерного пептида. Чтобы обеспечить её, в лидерной области имеется особый «сайт паузы». Достигнув его, РНК-полимераза приостанавливает транскрипцию, пока не начнётся трансляция. Таким образом процессы транскрипции и трансляции протекают синхронизированно.
Схожий механизм аттенюации имеет место при синтезе других аминокислот: гистидина, фенилаланина и треонина[4]. В аттенюаторе гистидинового оперона Escherichia coli имеется 7 гистидиновых кодонов, фенилаланинового — 7 фенилаланиновых кодонов[5].
Триптофановый оперон Bacillus subtilis
У Bacillus subtilis также имеется триптофановый оперон, транскрипция которого контролируется с помощью аттенюации, однако механизм его регуляции несколько отличается от такового у Escherichia coli. Шпильки могут образовываться в районах А—В и C—D аттенюатора, но лишь последняя вызывает терминацию транскрипции. В отсутствие триптофана образуется шпилька А—В. Так как области В и С частично перекрываются, образование такой шпильки препятствует образованию шпильки С—D, следовательно, транскрипция оперона идёт полностью. Ключевыми отличиями триптофанового оперона Bacillus subtilis от такового у Escherichia coli являются, во-первых, наличие 11 повторяющихся кодонов в лидерной мРНК (GAG или UAG), а также наличие особого связывающегося с РНК белка, называемого TRAP (от англ. trp RNA-binding Attenuation Protein). При высокой концентрации триптофана TRAP связывается с вышеуказанными повторяющимися последовательностями. Так как GAG/UAG-повторы охватывают всю область А, а также частично область В, то шпилька А—В не может образоваться. Это позволяет образоваться шпильке С—D, которая, как говорилось выше, является терминаторной. Таким образом, при наличии триптофана транскрипция trp-оперона блокируется[6].
См. также
Примечания
- ↑ Коничев, Севастьянова, 2012, с. 257—258.
- ↑ Dale, Park, 2004, с. 88.
- ↑ 1 2 3 Коничев, Севастьянова, 2012, с. 260.
- ↑ Daniel J, Saint-Girons I. Attenuation in the threonine operon: effects of amino acids present in the presumed leader peptide in addition to threonine and isoleucine. // Mol Gen Genet.. — 1982. — Т. 188, № 2. — С. 225—227.
- ↑ Dale, Park, 2004, с. 89.
- ↑ Dale, Park, 2004, с. 91—92.
Литература
- Коничев А. С., Севастьянова Г. А. Молекулярная биология. — Издательский центр «Академия», 2012. — 400 с. — ISBN 978-5-7695-9147-1.
- Jeremy W. Dale, Simon F. Park. Molecular Genetics of Bacteria. — 4th Edition. — John Wiley & Sons, Ltd, 2004. — ISBN 0 470 85084.
- Morse, DE; Mosteller RD; Yanofsky C (1969). "Dynamics of synthesis, translation, and degradation of trp operon messenger RNA in E. coli.". Cold Spring Harb Symp Quant Biol. 34: 725–40. PMID 4909527.
- Yanofsky, Charles (1981). "Attenuation in the control of expression of bacterial operons". Nature 289: 751–58.
Обычно почти сразу, изредка в течении часа.
