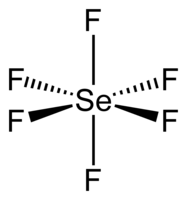
| Гексафторид селена | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Фторид селена(VI) |
| Традиционные названия | Гексафторид селена, шестифтористый селен |
| Хим. формула | SeF6 |
| Рац. формула | SeF6 |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 192,95 г/моль |
| Плотность | 7,887 г/л |
| Термические свойства | |
| Температура | |
| • плавления | -39; -34,6 °C |
| • сублимации | -46,6 °C |
| • кипения | −30 ± 1 ℉[1] |
| Энтальпия | |
| • образования | -1029 кДж/моль |
| • плавления | 7,1 кДж/моль |
| • кипения | 18,3 кДж/моль |
| Давление пара | 1 ± 1 атм[1] |
| Структура | |
| Дипольный момент | 0 Д |
| Классификация | |
| Рег. номер CAS | 7783-79-1 |
| PubChem | 24558 |
| Рег. номер EINECS | 620-577-8 |
| SMILES | |
| InChI | |
| RTECS | VS9450000 |
| ChEBI | 30434 |
| ChemSpider | 22964 |
| Безопасность | |
| Предельная концентрация | 0,2 мг/м³ |
| ЛД50 | 5 — 15 мг/кг |
| Токсичность | ядовит |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гексафторид селена (фторид селена(VI)) — неорганическое соединение селена и фтора, бесцветный газ. Химически менее инертен, чем гексафторид серы. Реагирует с газообразным аммиаком при нагревании. Имеет неприятный запах, ядовит, обладает удушающим и раздражающим действием даже в малых концентрациях[2].
Получение
- Получают сжиганием селена во фторе:
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0551.html
- ↑ ATSDR - Medical Management Guidelines (MMGs): Selenium Hexafluoride. www.atsdr.cdc.gov. Дата обращения: 16 октября 2019. Архивировано 16 октября 2019 года.
Литература
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Обычно почти сразу, изредка в течении часа.


